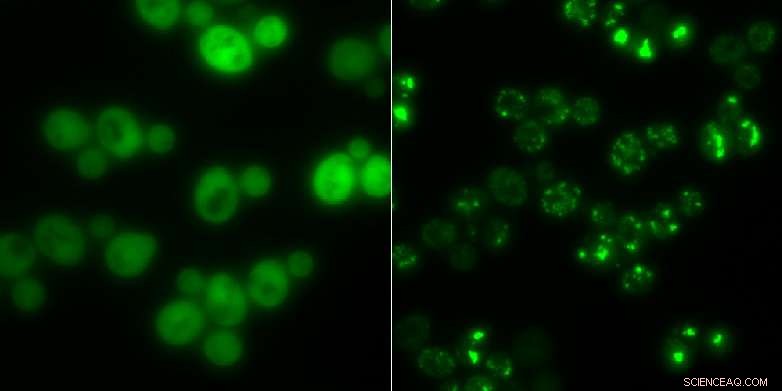
Cellule di lievito senza aggregati proteici (a sinistra) e quelle con (punti luminosi luminosi):In tempi di fame, i grumi servono come deposito temporaneo per le proteine. Credito:Matthias Peter / ETH Zurigo
I ricercatori dell'ETH hanno scoperto che la formazione di aggregati proteici nelle cellule di lievito è reversibile. Ciò getta nuova luce sulle malattie umane che possono essere attribuite a determinati aggregati proteici.
Gli aggregati proteici hanno una cattiva reputazione. Un certo numero di malattie umane, soprattutto quelli del sistema nervoso, come l'Alzheimer, Parkinson, o sclerosi laterale amiotrofica (SLA), sono dovute all'aggregazione di proteine degenerate nelle cellule nervose, creando aggregati che le cellule non possono dissolvere. Questo provoca la morte delle cellule.
Ora, i ricercatori guidati dal professor Matthias Peter e Reinhard Dechant dell'ETH hanno gettato nuova luce sugli aggregati proteici in uno studio che coinvolge le cellule di lievito. Il documento corrispondente è stato appena pubblicato sulla rivista Biologia cellulare naturale . Dentro, gli scienziati dell'ETH mostrano che nelle cellule di lievito si formano grumi di proteine in risposta a fattori di stress come la carenza di nutrienti o il calore. Se le cellule sopravvivono allo stress, possono dissolvere di nuovo gli aggregati, riciclare rapidamente i singoli componenti, e usarli per il metabolismo cellulare.
I grumi si formano in risposta allo stress
La scoperta dell'enzima Cdc19 da parte dei ricercatori è un esempio di una proteina che si aggrega sotto stress. L'enzima fornisce energia alle cellule. I ricercatori hanno scoperto che Cdc19 si scompone in quattro subunità identiche in caso di carenza di glucosio. Queste subunità cambiano quindi la loro forma originale e si aggregano insieme ad altre molecole, come acidi ribonucleici o altri enzimi, per formare aggregati. I ricercatori si riferiscono a questi grumi come granuli di stress. Una volta incorporato in un aggregato di questo tipo, Cdc19 diventa inattivo e non è più in grado di produrre combustibile per la cella. Durante questo periodo, la cellula non può né crescere né moltiplicarsi.
Però, il processo è reversibile. Non appena lo stress è passato, i granuli di stress si dissolvono, e le quattro subunità di Cdc19 si assemblano insieme in modo che l'enzima possa riprendere il suo ruolo nel metabolismo del glucosio.
I ciuffi hanno uno scopo chiaro, afferma Matthias Peter:"La cellula di lievito utilizza gli aggregati come una sorta di magazzino per importanti enzimi, in modo che questi siano protetti dalla rottura in situazioni di stress e possano essere riattivati immediatamente dopo che la cellula sopravvive allo stress." Gli aggregati, lui dice, proteggere queste molecole dall'essere scomposte dai meccanismi di smaltimento della cellula. Se la cellula dovesse sintetizzare nuovamente questi composti dopo ogni situazione di stress, costerebbe alla cellula molto tempo ed energia.
Una semplice sequenza è sufficiente per aggregare
I ricercatori hanno anche chiarito come e perché Cdc19 è in grado di formare grumi. Nella struttura di una subunità Cdc19, hanno individuato un breve, sottosezione spiegata con una composizione semplice. In termini tecnici, queste sezioni sono note come "regioni a bassa complessità" (LCR), e i ricercatori dicono che si verificano anche in altre proteine che formano aggregati in altri organismi, compresi gli umani.
"Gli LCR sono esposti a causa della rottura del complesso enzimatico e innescano il processo di aggregazione, "dice Peter. "Era quindi importante per noi trovare una sequenza di questo tipo in Cdc19. Ciò conferma che esiste un meccanismo generale." Nello stato normale del lievito, l'LCR di Cdc19 è nascosto, o ha diversi gruppi fosfato che l'LCR "disattiva". È solo in caso di stress nutritivo che emerge l'LCR e vengono rimossi i gruppi fosfato - e solo allora possono formarsi aggregati.
Una scoperta importante
"La nostra ricerca ha creato un senso di nuovo risveglio nella comunità scientifica, "dice Reinhard Dechant, un capogruppo presso l'Istituto di Biochimica, che ha condotto lo studio insieme a Matthias Peter. Fino ad ora, lui dice, gli aggregati sono stati visti principalmente come particelle patogene, perché l'unica cosa visibile nei pazienti è il risultato del processo - cioè, placche proteiche insolubili che causano una malattia. "Il nostro documento esamina anche l'inizio dell'aggregazione e come procede, "dice Dechant, spiegando che i grumi proteici non si formeranno semplicemente a causa di una malattia, ma piuttosto perché la cellula ne ha bisogno per sopravvivere a una situazione di stress. "Per la prima volta, siamo stati in grado di dimostrare che sia la formazione che la rottura degli aggregati è un meccanismo importante nelle cellule".
Altri gruppi di ricerca dell'ETH di Zurigo che esaminano gli aggregati nelle cellule di lievito hanno fatto scoperte simili in passato. Di conseguenza, altri scienziati dell'ETH sono stati in grado di dimostrare che i gruppi di proteine degenerate funzionano, tra l'altro, come un ricordo e aiuta le cellule a immagazzinare le esperienze passate (negative) (come riportato in ETH News). Sembra quindi che l'aggregazione funzionale di alcune proteine sia un meccanismo regolatorio molto diffuso.