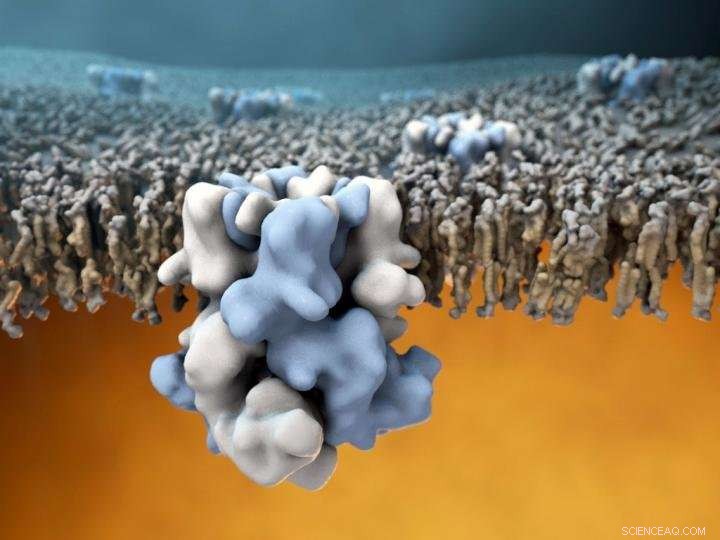
Il canale ionico TRPM8 (blu e bianco al centro) è incorporato nella membrana esterna delle cellule, ed è in grado di rilevare le temperature fredde all'esterno (la metà superiore dell'immagine), e comunicare queste informazioni all'interno caldo della cellula (metà inferiore dell'immagine). Credito:Gabe Lander e Graham Johnson
Un team di ricercatori del The Scripps Research Institute (TSRI) e della Duke University ha effettuato la prima determinazione della struttura atomica del Transient Receptor Potential Melastatin 8 (TRPM8), un sensore molecolare nelle estremità nervose che rileva le temperature fredde, nonché il mentolo e altre sostanze chimiche che inducono sensazioni di freddo.
Questa scoperta dovrebbe aumentare gli sforzi in corso da parte degli scienziati per mirare terapeuticamente a TRPM8. I composti farmacologici che interagiscono con il sensore del freddo, come già fanno gli unguenti contenenti mentolo, potrebbero essere in grado di trattare alcune forme di dolore cronico e infiammazione, emicranie e persino tumori.
"Conoscendo la struttura atomica di TRPM8 e come reagisce al freddo, il mentolo e altri stimoli dovrebbero aiutare nella progettazione di nuovi farmaci potenti e selettivi mirati a questo sensore, " ha affermato il leader dello studio Gabriel C. Lander, dottorato di ricerca, professore associato presso TSRI, che ha co-diretto lo studio con il dottor Seok-Yong Lee presso la Duke University School of Medicine.
La scoperta, pubblicato il 7 dicembre, 2017 sulla rivista Scienza , è anche un'impresa tecnica significativa. Da quando la proteina sensibile al freddo è stata identificata per la prima volta nel 2002, squadre di tutto il mondo hanno provato, ma non sono riuscite, a determinare la struttura atomica di TRPM8 utilizzando la cristallografia a raggi X, tradizionalmente il metodo di riferimento per la risoluzione di strutture a grandi proteine. Ottenere una struttura ad alta risoluzione di TRPM8 ha rappresentato una grande sfida per i biologi strutturali, in parte a causa dell'instabilità del canale quando isolato dal suo ambiente nativo nella membrana cellulare. Senza supporto membrana, TRPM8 ha la tendenza a perdere la sua integrità strutturale, rendendo il target molto difficile da studiare. Anche la struttura del sensore TRPM8 è relativamente complessa, essendo composto da quattro copie identiche della proteina codificata dal gene TRPM8.
Per questo progetto, Lander e co-primo autore Mengyu Wu, uno studente laureato nel suo laboratorio, ha optato invece per utilizzare la microscopia crioelettronica (crio-EM), un metodo di determinazione della struttura che è sempre più preferito per difficili studi strutturali. Lee e il suo team hanno iniziato esaminando le proteine TRPM8 di più di una dozzina di specie animali diverse, compresi gli umani, i topi, e uccelli, per trovarne uno che si sarebbe comportato meglio per uno studio crio-EM. Hanno optato per la proteina TRPM8 di un uccello chiamato pigliamosche dal collare.
"Tutte le prove indicano che il pigliamosche TRPM8 funziona allo stesso modo dei TRPM8 dei mammiferi, quindi siamo fiduciosi che la nostra analisi strutturale si tradurrà direttamente nella forma umana di questo sensore, " ha detto Lander.
Gli scienziati hanno dovuto affrontare molti ostacoli a causa dell'instabilità intrinseca di TRPM8 al di fuori del suo ambiente di membrana nativo. "Anche entro un solo giorno dalla spedizione dei campioni da Duke a TSRI, il complesso proteico inizierebbe a sfaldarsi, " ha detto Wu. "Il laboratorio di Lee ha aggiunto strategicamente alcune mutazioni stabilizzanti alla proteina in modo che fosse meno incline alla degradazione ." Ying Yin, uno studente laureato nel laboratorio di Lee, è anche tornato indietro e vagliato meticolosamente attraverso diverse condizioni di purificazione per conferire ulteriore stabilità al campione.
La proteina si è anche comportata in modo diverso dalla maggior parte dei campioni su cui normalmente lavora il laboratorio Lander per la microscopia elettronica, e i ricercatori hanno impiegato più di un anno per identificare le condizioni giuste per visualizzare questa impegnativa biomolecola.
"Abbiamo dovuto buttare via il regolamento e ripensare al solito approccio per risolvere questo tipo di struttura, " disse Lander.
Attraverso questi adattamenti, i ricercatori sono stati in grado di ottenere il primo assaggio strutturale di TRPM8 con una risoluzione complessiva di circa 4 Angstrom (0,4 miliardesimi di metro). Anche il modello atomico risultante conteneva alcune sorprese. "Altri gruppi hanno ipotizzato la struttura di TRPM8 e come interagisce con partner leganti come il mentolo, ma quello che abbiamo scoperto è che praticamente tutte queste ipotesi plausibili erano piuttosto lontane, " disse Lander. In particolare, la tasca della rilegatura per il mentolo si è rivelata in una posizione inaspettata, diversa dalla posizione di legame del ligando in altri sensori TRP.
"Una cosa che questa struttura ci dice è che i sensori TRP non funzionano tutti allo stesso modo, e quindi mi aspetto che scopriremo molti nuovi meccanismi di sensori mentre studiamo di più su queste strutture TRP, " ha detto Lander.
TRPM8 è di interesse per l'industria farmaceutica in parte a causa dell'analgesico, effetti antinfiammatori che può avere quando attivato. Inoltre, varianti del suo gene sono state collegate a una predisposizione all'emicrania, e gli scienziati hanno dimostrato che la manipolazione di TRPM8 può causare dolore simile all'emicrania negli animali.
"TRPM8 è anche espresso in modo anomalo in alcune prostata, al seno e altri tumori, rendendolo un potenziale bersaglio chemioterapico, " disse Wu.
Sebbene TRPM8 sia meglio conosciuto come sensore del nervo periferico di temperature moderatamente fredde (inferiori a circa 25° C) e di molecole sensibili al freddo come il mentolo, si trova anche in molti altri tessuti normali, anche nel profondo del corpo, e le sue funzioni in quei tessuti rimangono in gran parte poco chiare. Una comprensione dettagliata dell'interazione strutturale di TRPM8 con i suoi partner di legame naturali dovrebbe portare allo sviluppo di sonde molecolari migliori che possono aiutare gli scienziati a rivelare le sue varie funzioni.
I laboratori Lander e Lee stanno ora lavorando per capire meglio come il TRPM8 interagisce con il mentolo e altre molecole partner di legame terapeutico.