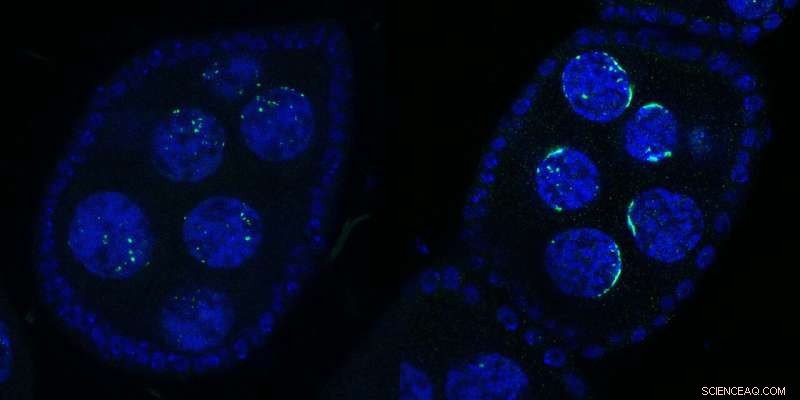
Due camere per uova di Drosophila contenenti diversi nuclei:Wild Type (a sinistra) o dopo l'inattivazione di Kipferl (a destra). Il DNA è mostrato in blu e Rhino in verde. Dopo la mutazione o la delezione della proteina partner Kipferl (a destra), Rhino perde la sua affinità per le sequenze del cluster di piRNA attraverso il genoma (punti verdi nel pannello di sinistra) ma viene sequestrato dagli array pericentromerici Satellite (forme a forma di mezzaluna verde a destra pannello). Le forme a mezzaluna hanno ispirato il nome “Kipferl”, nome di una pasticceria austriaca. Credito:Baumgartner/Brennecke/IMBA
Gran parte del nostro DNA è costituito da elementi egoistici ripetitivi del DNA, alcuni dei quali possono saltare da un sito all'altro del genoma, danneggiando potenzialmente il genoma. I ricercatori dell'Istituto di biotecnologia molecolare dell'Accademia austriaca delle scienze (IMBA) descrivono come diversi tipi di elementi ripetitivi del DNA sono controllati dallo stesso meccanismo di silenziamento nelle ovaie dei moscerini della frutta.
Al centro delle loro scoperte c'è una proteina non caratterizzata che i ricercatori hanno chiamato "Kipferl", che garantisce il controllo efficace dei geni di salto. I risultati suggeriscono che diversi elementi egoistici competono per il sistema di difesa del genoma ospite e che Kipferl potrebbe essere il primo di una serie di molecole che agiscono in modo simile ancora da scoprire. I risultati sono pubblicati su eLife .
Circa la metà del genoma umano e un quinto del genoma del moscerino della frutta è composto da parassiti genetici simili a geni che possono fare copie di se stessi e inserirsi in aree casuali del nostro genoma, interrompendo potenzialmente la normale espressione genica. Si sono evoluti molteplici meccanismi di difesa per tenere sotto controllo questi cosiddetti trasposoni.
Uno di questi meccanismi è un sistema di interferenza dell'RNA chiamato percorso piRNA. Il percorso piRNA è un piccolo percorso di silenziamento dell'RNA conservato in tutto il regno animale, dalle spugne ai mammiferi. Questo meccanismo di silenziamento utilizza piRNA generati da sequenze ricche di trasposoni nel DNA chiamate "cluster di piRNA".
I piRNA sono piccoli RNA che si accoppiano con le cosiddette proteine Argonaute del macchinario di silenziamento per indirizzare i trasposoni complementari alla loro sequenza. Quindi, questi piRNA servono come schemi per identificare e silenziare i trasposoni con sequenze complementari nel genoma, indipendentemente da quanto sono stati in grado di saltare.
Il moscerino della frutta Drosophila melanogaster, in cui è stata identificata per la prima volta la via del piRNA, utilizza una proteina chiamata "Rhino" per trovare cluster di piRNA nel genoma. Tuttavia, il modo in cui Rhino riconosce i cluster di piRNA nel DNA è rimasto sconosciuto.
"Precedenti dati in vitro avevano mostrato un'affinità di Rhino per uno specifico segno epigenetico, la modifica della cromatina H3K9me3", afferma il leader del gruppo IMBA Julius Brennecke, l'autore corrispondente dello studio. Questa modifica è un marcatore di "eterocromatina", una forma di DNA compatto in cui i geni sono silenziati.
Tuttavia, H3K9me3 non è specifico per i cluster di piRNA, ma si trova spesso anche in altre regioni densamente popolate del genoma. Lì, H3K9me3 è legato alla principale proteina eterocromatina 1 (HP1), un parente stretto di Rhino.
Il motivo per cui HP1 e Rhino si legano a diversi sottoinsiemi di eterocromatina, anche se entrambi hanno un'affinità comparabile per la stessa modifica della cromatina, non è stato a lungo chiaro. "Senza dubbio, era necessario H3K9me3, ma non sufficiente per spiegare il legame di Rhino con la cromatina. Quindi, sapevamo che dovevano esserci ulteriori segnali molecolari che aiutano Rhino a indirizzare i cluster di piRNA", aggiunge Brennecke.
Nella ricerca di questo segnale molecolare, il team ha catalogato gli interattori diretti di Rhino, alla ricerca di una proteina partner che potrebbe essere in grado di guidare Rhino verso i cluster di piRNA. Utilizzando una combinazione di approcci genetici, genomici e di imaging, i ricercatori hanno identificato il "compagno" di Rhino nelle ovaie di Drosophila:una proteina contenente diverse pieghe del dito di zinco che hanno chiamato "Kipferl".
Kipferl non si lega solo a Rhino, ma usa anche le sue dita di zinco per il legame specifico della sequenza ai motivi del DNA ricchi di guanosina. Il team ha scoperto che la maggior parte dei cluster di piRNA sono definiti attraverso la combinazione dei siti di legame del DNA specifici di Kipferl con l'eterocromatina locale. In questi siti, l'interazione di Rhino con i segni epigenetici H3K9me3 è stabilizzata da Kipferl, il che spiega perché Rhino si lega solo a una piccola parte di tutta l'eterocromatina presente nel genoma.
Per aggiungere un livello di complessità, il team sapeva che Rhino non si localizza solo nei cluster di piRNA. Recentemente è stato dimostrato che Rhino si lega ai cosiddetti "array satellitari". Si tratta di sequenze ripetitive di DNA non codificante e non trasposto che si trovano vicino ai centromeri dei cromosomi.
"Abbiamo riscontrato un effetto sorprendente su Rhino quando abbiamo generato mosche con Kipferl mutante o assente e le abbiamo osservate al microscopio", afferma la prima autrice Lisa Baumgartner, dottoranda nel laboratorio Brennecke presso l'IMBA. Quando Kipferl è stato mutato, Rhino non si è più localizzato nei cluster di piRNA attraverso il genoma. Invece, si è fortemente accumulato negli array di satelliti genomici.
"Invece di punti più piccoli distribuiti attorno al nucleo, abbiamo visto Rhino formare forme distinte a forma di mezzaluna. Sulla base di questa primissima osservazione, abbiamo chiamato la nuova proteina 'Kipferl', in onore di una popolare pasticceria austriaca a forma di croissant. Abbiamo scoperto solo molto in seguito che queste strutture corrispondevano a tratti di mega-base di array di satelliti". Pertanto, gli scienziati hanno dimostrato che Kipferl ha contribuito a distribuire correttamente Rhino ai cluster di piRNA ed evitarne il sequestro negli array di satelliti.
Il rinoceronte è una delle proteine in più rapida evoluzione nel genoma della mosca. Brennecke e il suo team ipotizzano che questa rapida evoluzione potrebbe essere dovuta a una pressione evolutiva positiva proveniente dagli array di satelliti.
"Gli array Satellite non si traspongono ma possono ricombinarsi. Tuttavia, se lo fanno in modo incontrollato, interi bracci cromosomici potrebbero andare persi. Quindi, gli array Satellite potrebbero aver bisogno di un meccanismo di controllo che coinvolga Rhino e altri componenti del percorso piRNA per aiutarli a impacchettarli in una stretta eterocromatina. Questo potrebbe essere il motivo per cui gli array Satellite sembrano voler sequestrare tutto il Rhino che sono riusciti a trovare", spiega Baumgartner.
Baumgartner pensa che Rhino e il percorso piRNA potrebbero avere ruoli molto diversi nelle loro interazioni con gli array Satellite o i cluster e trasposoni piRNA. "Il salto e la moltiplicazione dei trasposoni rappresentano un pericolo per la funzionalità del genoma, rendendo così necessario che il percorso del piRNA li zittisca", afferma.
"Pertanto, agli occhi dei trasposoni, il percorso del piRNA è il 'nemico' che impedisce loro di diffondersi attraverso il genoma. Gli array satellitari, d'altra parte, necessitano semplicemente di un ulteriore livello di controllo per garantire che possano mantenere la loro copia elevata numero senza danneggiare il genoma attraverso una ricombinazione indesiderata. Pertanto, agli occhi degli array di satelliti, immagino che Rhino sia un fattore che garantisce la loro sopravvivenza", elabora.
Sulla base di queste osservazioni e analisi, gli scienziati suggeriscono che gli array Satellite potrebbero utilizzare un'altra proteina partner come Kipferl per aiutare a localizzare Rhino nel loro DNA.
"Per contrastare il sequestro di Rhino da parte degli array Satellite, ipotizziamo che Kipferl potrebbe essersi evoluto per la necessità di aiutare a reindirizzare Rhino ai cluster di piRNA. Quindi, i nostri risultati suggeriscono che Rhino potrebbe essere coinvolto in un fuoco incrociato di conflitti genetici". dice Brennecke. Inoltre, Rhino è espresso sia nei testicoli che nelle ovaie nel moscerino della frutta, mentre Kipferl è espresso solo nelle ovaie. "Kipferl potrebbe essere il primo di numerosi fattori guida di Rhino ancora da scoprire", conclude Brennecke. + Esplora ulteriormente