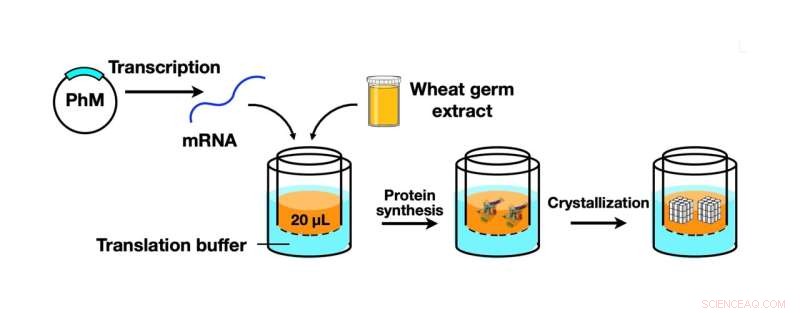
Illustrazione schematica del processo CFPC utilizzando un kit di sintesi proteica del germe di grano per sintetizzare il monomero di poliedrina (PhM) che è stato ulteriormente cristallizzato in cristalli di poliedri di dimensioni nanometriche. Crediti:Prof. Takafumi Ueno
Il nuovo metodo di cristallizzazione delle proteine prive di cellule (CFPC) sviluppato da Tokyo Tech include la cristallizzazione diretta delle proteine ed è un importante progresso nel campo della biologia strutturale. Questa tecnica consentirà l'analisi di proteine instabili che non potrebbero essere studiate con metodi convenzionali. L'analisi di questi aumenterà la nostra conoscenza dei processi e delle funzioni cellulari.
Mentre abbiamo familiarità con alcuni cristalli come il sale e lo zucchero che usiamo nella nostra vita quotidiana, c'è un altro insieme di cristalli, nascosto ad occhio nudo, che è cruciale per la nostra biologia. I microscopici cristalli proteici si trovano nelle cellule viventi e aiutano a sostenere processi come l'attivazione del sistema immunitario, la conservazione e la protezione delle proteine.
Per comprendere meglio la relazione tra struttura e funzione dei cristalli proteici, gli scienziati hanno sviluppato il metodo di cristallizzazione proteica in-cell (ICPC), che può osservare direttamente i cristalli proteici nelle cellule viventi, garantendo cristalli di alta qualità senza la necessità di processi di purificazione o screening complessi metodi. Tuttavia, nonostante i suoi numerosi vantaggi, sono state riportate pochissime strutture perché i cristalli formati nelle cellule viventi non avevano le dimensioni e la qualità necessarie per l'analisi. Quindi, un team di ricercatori dal Giappone, guidato dal Prof. Takafumi Ueno della Tokyo Tech mirava a sviluppare un metodo migliore. E di recente hanno raggiunto una svolta.
Nel loro articolo pubblicato in Rapporti scientifici , il team ha segnalato lo sviluppo di una tecnica che renderebbe la cristallizzazione e l'analisi delle proteine più efficienti ed efficaci. Questa tecnica, un metodo di cristallizzazione delle proteine senza cellule (CFPC), era un ibrido tra la cristallizzazione delle proteine in vitro e l'ICPC e consentiva la formazione rapida e diretta di cristalli proteici senza la necessità di complicati metodi di cristallizzazione e purificazione.
Le immagini di microscopia elettronica a scansione e gli istogrammi di distribuzione delle dimensioni dei cristalli di poliedri (PhC) mostrano vari punti nel processo CFPC dipendente dal tempo. Crediti:Prof. Takafumi Ueno
Tornando al team che conduce lo studio in corso (alcuni dei quali sono anche membri del Laboratorio di Ueno), hanno utilizzato un kit di sintesi proteica del germe di grano, che è uno strumento per la sintesi del monomero poliedrico, una proteina virale prodotta nelle cellule degli insetti da infezione da cypovirus. Questa proteina è stata quindi cristallizzata utilizzando il nuovo metodo CFPC, portando alla formazione di cristalli di poliedri di dimensioni nanometriche (PhC). Il team ha potuto completare in modo efficiente questo processo entro sei ore, utilizzando solo 20 microlitri della miscela di reazione.
Le immagini di microscopia elettronica a scansione hanno indicato che i PhC avevano un'eccellente purezza, che ha consentito la determinazione della loro struttura a una risoluzione fino a 1,95 Å (o 1,95 angstrom). Per esplorare ulteriormente le capacità del loro nuovo sistema, il team ha effettuato l'analisi strutturale della proteina di inclusione cristallina A (CipA). La sua struttura è stata determinata con un'alta risoluzione di 2,11 Å, qualcosa che non era mai stato riportato prima di questo studio.
Questo lavoro rappresenta un grande passo avanti nel campo della biologia strutturale poiché il metodo proposto consentirà l'analisi di proteine instabili ea basso rendimento che non possono essere studiate con i metodi convenzionali. Questa tecnologia mira anche a favorire lo sviluppo di tecniche avanzate per la cristallizzazione e l'analisi rapida e su piccola scala delle proteine. "I cristalli proteici di alta qualità prodotti dal nostro metodo amplieranno gli orizzonti della determinazione strutturale e ci forniranno informazioni utili e senza precedenti sul complesso ambiente delle cellule viventi", afferma il prof. Ueno. + Esplora ulteriormente