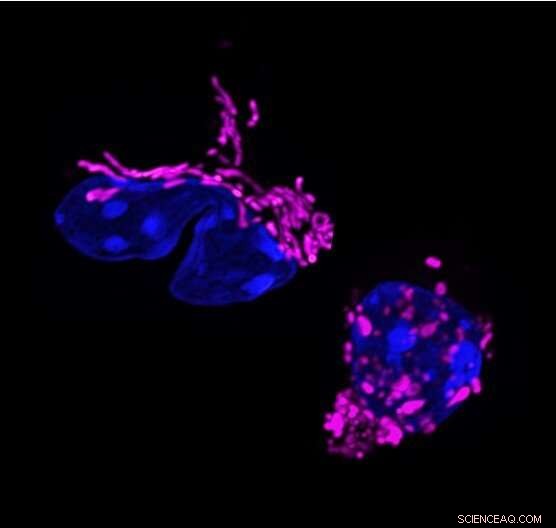
Mutaforma mitocondriale nella risposta dei linfociti T. I cambiamenti dinamici nella forma mitocondriale si collegano alla funzione dei linfociti T. Le cellule T helper 17 mostrano mitocondri allungati (colorati in viola, a sinistra). L'eliminazione della proteina di modellatura della membrana mitocondriale OPA1, frammenta i mitocondri nei linfociti T (a destra) e altera la risposta dei linfociti T. Credito:Francesc Baixauli
Un nuovo studio incentrato sulle cellule Th17 del sistema immunitario suggerisce che la forma e la funzione dei loro mitocondri sono importanti nei disturbi autoimmuni e infiammatori, come la sclerosi multipla. Le cellule T helper 17 (Th17) sono un tipo di cellula immunitaria T CD4+, che collettivamente aiutano a produrre anticorpi, attivare le cellule che si nutrono di nemici e reclutare più soldati sul fronte di battaglia.
La ricerca, guidata da Erika Pearce, Ph.D., presso il Bloomberg~Kimmel Institute for Cancer Immunotherapy presso il Johns Hopkins Kimmel Cancer Center, suggerisce che l'apprendimento dell'impatto dei mitocondri sulle cellule Th17 è la chiave per capire come controllarle.
Lo studio, pubblicato il 28 settembre sulla rivista Nature , identifica diverse strade per cercare di influenzare il comportamento di queste importanti cellule, con l'obiettivo di smorzare la loro attività autoimmune.
Quando una cellula T viene esposta per la prima volta a un nemico, risponde ai segnali del nemico e dell'ambiente per diventare uno dei diversi tipi di cellule T specializzate, ciascuna armata con funzioni distinte nella risposta immunitaria. Sebbene tutti i sottotipi di cellule T helper siano cruciali per la lotta dell'organismo contro gli stranieri, il loro squilibrio può anche causare malattie, tra cui diabete di tipo 1, asma, allergie e infiammazioni croniche.
"Se potessimo controllare le cellule T, potremmo probabilmente controllare molte, se non la maggior parte, infezioni, autoimmunità e tumori", afferma Pearce, autore senior dello studio e Distinguished Professor Johns Hopkins Bloomberg presso il Dipartimento di Oncologia e il Dipartimento di Biochimica e Biologia Molecolare.
Lo studio è iniziato quando i ricercatori del laboratorio di Pearce, che allora si trovava al Max Planck Institute di Friburgo, in Germania, hanno notato un tratto peculiare delle cellule Th17. Tra i tre principali tipi di cellule T effettrici, solo le cellule Th17 avevano mitocondri allungati; cioè, i loro propulsori interni sono stati fusi insieme in strutture più grandi. "Era strano perché i mitocondri allungati sono generalmente visti nelle cellule a riposo e non nelle cellule attivate", afferma il primo autore Francesc Baixauli, Ph.D., un ex borsista post-dottorato presso il Max Planck Institute.
I ricercatori sapevano che il gene OPA1 regola la fusione mitocondriale, quindi lo hanno eliminato nelle cellule Th17 e hanno scoperto che i loro mitocondri erano tornati a una dimensione e una forma più frammentate. Tuttavia, le cellule hanno anche smesso di svolgere il loro lavoro principale:produrre la molecola di segnalazione interleuchina-17 (IL-17).
Per confermare questo risultato in un organismo, i ricercatori hanno eliminato il gene OPA1 nei topi e promosso una malattia in questi animali che modella la sclerosi multipla umana, che è guidata dalle loro cellule Th17. Con l'eliminazione di OPA1, non solo le loro cellule hanno smesso di produrre IL-17, ma i sintomi della malattia sono diminuiti.
Chiedendosi come l'eliminazione di OPA1 abbia fermato la produzione di IL-17, il team ha inizialmente pensato che i mitocondri delle cellule semplicemente non stessero producendo abbastanza energia. Tuttavia, hanno scoperto che l'eliminazione di OPA1 non ha influenzato la produzione di energia e che l'OPA1 era cruciale per la produzione di IL-17 indipendentemente dal fatto che l'attività metabolica delle cellule fosse alta o bassa. Quindi, hanno scoperto che un processo biochimico centrale che si verifica nei mitocondri era stato alterato, causando l'accumulo di un metabolita noto per influenzare il DNA e il programma trascrizionale della cellula. "Quella molecola stava smorzando la capacità della cellula di leggere il suo DNA e, di conseguenza, IL-17 non veniva più prodotto", afferma Baixauli.
Per identificare la connessione tra queste risposte e la delezione di OPA1, i ricercatori hanno confrontato le proteine prodotte dalle cellule Th17 normali e quelle senza OPA1. Nelle cellule prive di OPA1, hanno riscontrato un forte aumento della forma attivata della proteina LKB1, che è un sensore metabolico che regola il metabolismo cellulare, la divisione cellulare e la funzione mitocondriale. Quando hanno eliminato sia OPA1 che LKB1 dalle cellule, la produzione di IL-17 è stata ripristinata e i processi mitocondriali sono tornati alla normalità.
"Pensiamo che LKB1 rilevi lo stress mitocondriale e alteri le reazioni biochimiche dei mitocondri in modo appropriato, il che influisce sulla produzione di IL-17", afferma Pearce. "Ora abbiamo un breve elenco di molecole note per influenzare questo aspetto chiave della funzione Th17, che può essere il punto di svolta tra i suoi ruoli utili e dannosi. La nostra ricerca futura continuerà a esplorare queste relazioni in modo da potersi sperare un giorno modificare terapeuticamente loro." + Esplora ulteriormente