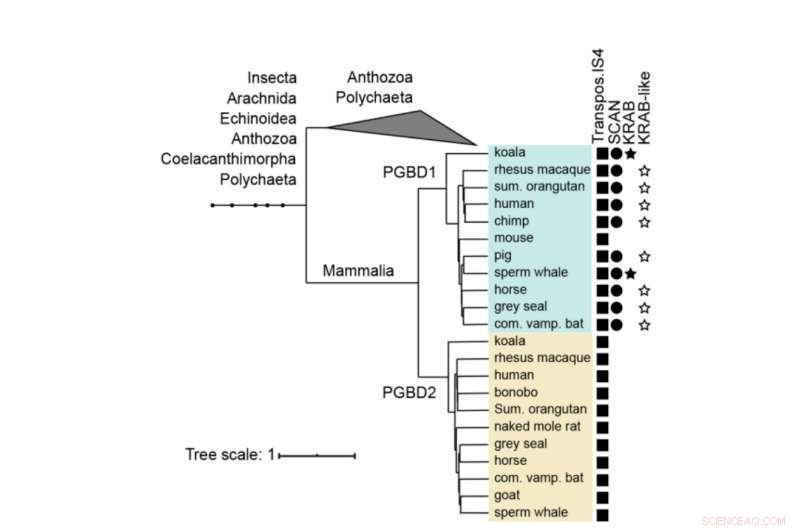
Albero filogenetico di PGBD1 e PGBD2. Viene mostrata la presenza dei domini derivati dalla trasposasi, SCAN e KRAB. I PGBD1 e PGBD2 umani, con le sequenze più strettamente correlate (contenenti la trasposasi IS4) sono stati allineati con i muscoli ed è stato costruito un albero utilizzando MrBayes. I domini proteici sono stati annotati con hmmerscan e CDD (NCBI). Il dominio KRAB è stato annotato con Phyre2. Credito:Biologia molecolare ed evoluzione (2022). DOI:10.1093/molbev/msac175
L'evoluzione è spesso descritta come un processo di "armeggiare", che fa uso di lievi modifiche alle capacità preesistenti. Allora come fanno gli organismi a sviluppare strutture nuove di zecca?
Un nuovo studio della dott.ssa Zsuzsanna Izsvák del Max Delbrück Center for Molecular Medicine dell'Helmholtz Association (Max Delbrück Center) e del professor Laurence Hurst del Milner Center for Evolution dell'Università di Bath (Regno Unito) ha trovato prove che l'evoluzione di un nuovo gene è alla base dell'evoluzione di una nuova struttura che si trova nelle cellule nervose. Descrivono questo gene insolito chiamato piggyBac Transposable Element-derived 1, o PGBD1, nella rivista Biologia molecolare ed evoluzione .
'I geni che saltano' causano mutazioni
PGBD1 è uno dei cinque geni PGBD correlati che mostra una netta somiglianza con l'elemento piggyBac identificato per la prima volta negli insetti, da cui il nome derivato dall'elemento trasponibile piggyBac. Gli elementi PiggyBac sono "geni saltellanti", chiamati anche trasposoni. Sono in grado di copiare se stessi e di spostarsi da una posizione all'altra del genoma, introducendo talvolta mutazioni o modificando funzioni. I trasposoni PiggyBac sono arrivati nella nostra specie tramite trasferimento orizzontale, in modo simile a come alcuni virus possono integrare il loro genoma nel nostro DNA.
Tuttavia, mentre i trasposoni piggyBac hanno perso la loro capacità di saltare nel nostro DNA nel tempo, cinque geni derivati da elementi trasponibili piggyBac (PGBD1-5) sono stati fissati negli esseri umani. "Volevamo scoprire quale funzione potenzialmente utile potrebbero avere i geni PGBD", afferma Zsuzsanna Izsvák. "Per questo studio, ci siamo concentrati su PGBD1."
Tra i cinque geni PGBD, PGBD1 è unico in quanto ha incorporato anche parti di altri geni, risultando in una proteina che ha parti extra in grado di legare altre proteine e di legare il DNA. PGBD1 è quindi un nuovo gene che è in parte un frammento di gene umano, in parte un gene che salta inattivo.
PGBD1 regola le cellule nervose e le loro "trappole proteiche"
PGBD1 si trova solo nei mammiferi. È particolarmente attivo nelle cellule che diventano neuroni. I ricercatori hanno prima studiato dove la proteina PGBD1 si lega al DNA, osservando che si incolla dentro e intorno ai geni associati allo sviluppo del nervo. Hanno scoperto che PGBD1 controlla lo sviluppo delle cellule nervose bloccando i geni espressi nelle cellule nervose mature mantenendo attivati quei geni associati all'essere cellule pre-nervose. La riduzione del livello di PGBD1 nelle cellule prenervose ha fatto sì che iniziassero a svilupparsi come cellule nervose.
Uno dei geni a cui si lega la proteina PGBD1 ha particolarmente attirato il loro interesse. NEAT1 è uno strano gene che codifica per un RNA che, insolitamente, non continua a produrre una proteina. Invece, questo prodotto, un RNA non codificante, costituisce la spina dorsale di una struttura fisica, i paraspeckles. Si tratta di minuscole strutture nei nuclei di alcune delle nostre cellule che agiscono come trappole per alcuni RNA e proteine.
I ricercatori hanno scoperto che nelle cellule pre-nervose la proteina PGBD1 si lega al gene NEAT1 e ne impedisce il funzionamento. Tuttavia, quando i livelli di PGBD1 scendono, i livelli di RNA di NEAT1 aumentano, si formano paramacchietti e le cellule diventano cellule nervose mature. PGBD1 si è quindi evoluto per essere un regolatore chiave della presenza o assenza di paramacchie, e quindi il regolatore dello sviluppo delle cellule nervose.
L'evoluzione non è un armeggiare a caso
Ciò che, tuttavia, è più intrigante è che i paraspeckles sono, come PGBD1, anche specifici dei mammiferi. PGBD1 è quindi un raro esempio di un nuovo gene che si è evoluto per regolare una nuova struttura, anche se piuttosto piccola. Zsuzsanna Izsvák, co-autore senior del Max Delbrück Center, afferma:"Questa è una scoperta davvero insolita e fortuita. Sappiamo che la duplicazione di geni preesistenti può essere alla base dell'evoluzione della novità, ma questo è un raro esempio di evoluzione più che un semplice armeggiare. Questo è un nuovo gene per controllare una nuova struttura". La domanda interessante ora è se svolga un ruolo anche nei neuroni adulti.
L'autore co-senior, il professor Laurence Hurst del Milner Center for Evolution presso l'Università di Bath, aggiunge che "hanno capito come vengono controllati i paraspeckle, ora dobbiamo solo capire come si è evoluto il paraspeckle stesso. Questo potrebbe essere un compito molto più difficile poiché gli RNA non codificanti come NEAT1 tendono ad evolversi rapidamente e quindi difficili da tracciare nel tempo evolutivo."
Questo accoppiamento tra NEAT1 e PGBD1 può anche essere coinvolto nella schizofrenia. Sebbene NEAT1 sia stato precedentemente associato a questa malattia neurologica, il team ha identificato alcune mutazioni in PGBD1 che potrebbero mostrare che erano comuni anche nei pazienti con schizofrenia:una di queste mutazioni modifica la proteina di PGBD1 mentre altre possono controllarne il livello.
Primo autore Dr. Tamas Raskó, al momento dello studio un ricercatore post-dottorato nel gruppo di Zsuzsanna Izsvák afferma che "è sicuramente più che una coincidenza che entrambi i geni siano coinvolti nella schizofrenia. È molto insolito trovare una mutazione che cambia un proteina che è accoppiata a questa malattia. Gli effetti di questa mutazione devono essere una priorità per ulteriori studi". + Esplora ulteriormente