Ricercatori australiani hanno fatto luce sulle capacità di mutare forma degli assemblaggi proteici, con risultati che potrebbero rivoluzionare campi dalla bioproduzione allo sviluppo di vaccini.
Ricerca condotta dal dottor Taylor Szyszka e dal dottor Yu Heng Lau dell'Università di Sydney, dell'ARC Center of Excellence in Synthetic Biology, pubblicata oggi negli Proceedings of the National Academy of Sciences approfondisce l'intricato mondo delle incapsulazioni. Queste gabbie proteiche icosaedriche svolgono un ruolo cruciale nella realizzazione di nanoreattori, poiché i loro pori fungono da porte per minuscole nanofabbriche.
"Manipolando i pori e modificandone le dimensioni e la carica, possiamo avere un migliore controllo sui substrati che entrano nelle gabbie e vengono trasformati in prodotti dagli enzimi confezionati all'interno", afferma la dott.ssa Szyzska.
Tuttavia, l'esplorazione del team ha preso una svolta inaspettata quando hanno iniziato ad apportare lievi mutazioni per osservarne gli effetti.
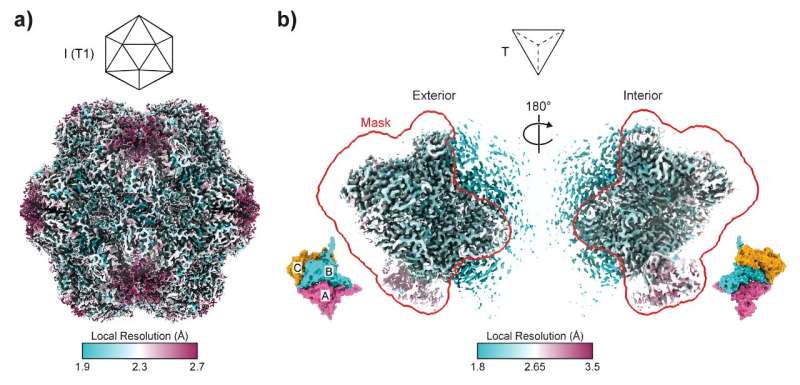
Questo lancio di dadi molecolari ha portato alla creazione di strutture simili ai tetraedri, una forma piramidale molto diversa dalle solite incapsulazioni sferiche. In termini di forma dell'assemblaggio, è come cambiare un dado a 20 facce in un dado a quattro facce. Questi gruppi tetraedrici, che comprendono solo 36 subunità proteiche rispetto alle solite 180, aprono un regno di possibilità precedentemente inesplorate nell'ingegneria proteica
"Quello che abbiamo scoperto è che sono necessarie mutazioni minime per cambiare drasticamente la forma dell'assemblaggio finale", afferma il dott. Szyszka. "Ci aspettavamo che fosse un processo molto più complicato."
I risultati dello studio non solo mettono in discussione le conoscenze esistenti sull'assemblaggio delle proteine, ma offrono anche approfondimenti sulla biologia evolutiva. Le incapsulazioni, pur non essendo i virus stessi, condividono legami evolutivi con le strutture virali. I ricercatori ipotizzano che la flessibilità osservata nelle incapsuline potrebbe essere attribuita alle dimensioni del loro carico più piccole rispetto ai virus, influenzando potenzialmente la loro capacità di adottare forme diverse.
"Questa scoperta suggerisce che esistono altre forme che possiamo realizzare, con ampie implicazioni per la bioingegneria e la bioproduzione", afferma il dott. Szyszka.
Con ulteriori ricerche, il team spera di sbloccare il pieno potenziale di queste proteine che cambiano forma, aprendo la strada a innovazioni che potrebbero rimodellare le industrie e migliorare la salute umana.
Ulteriori informazioni: Taylor N. Szyszka et al, La mutazione puntiforme in un capside simile a un virus guida la riduzione della simmetria per formare gabbie tetraedriche, Atti dell'Accademia nazionale delle scienze (2024). DOI:10.1073/pnas.2321260121
Informazioni sul giornale: Atti dell'Accademia Nazionale delle Scienze
Fornito dal Centro di eccellenza in biologia sintetica ARC (CoESB)