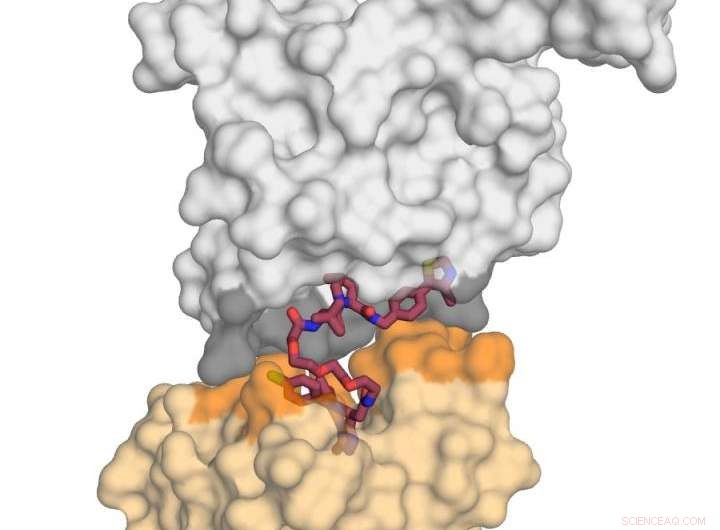
L'immagine mostra la proteina E3 ligasi VHL (in grigio) in complesso con la piccola molecola MZ1 (in lampone) e "bacia" la proteina BRD4 (in giallo). Dopo aver ricevuto questo "bacio" mortale, BRD4 è destinato alla degradazione. Credito:Xavier Lucas, Alessio Ciulli, Università di Dundee
Gli scienziati dell'Università di Dundee hanno riportato un importante passo avanti nel prendere di mira le cause di molte malattie, usando un "bacio della morte" per distruggere proteine che in precedenza erano state considerate "non drogabili".
Si sa molto su proteine come Ras e Myc che sono note per essere colpevoli nel cancro umano, e Huntingtina, che causa la malattia di Huntingdon, ma finora si sono dimostrati ostinatamente resistenti agli sforzi per trovare il modo di affrontarli con la droga.
Ora i ricercatori guidati dal professor Alessio Ciulli della School of Life Sciences di Dundee hanno trovato un modo per colpire proteine simili, utilizzando un approccio a piccole molecole in modo non convenzionale per colpire le proteine "cattive" legandole ad agenti neutralizzanti per avviare un processo di degradazione, e quindi rimuoverli del tutto.
"Conosciamo molte proteine che sono attive nel causare malattie, ma che non siamo stati in grado di impedire che diventino "canaglia" o di fermarli quando lo fanno, " disse il professor Ciulli.
"Il problema principale è che non siamo stati in grado di trovare le piccole molecole che possono legarsi con successo a queste proteine e allo stesso tempo ostacolare la loro funzione. È un'area altamente complessa:queste proteine possono spesso ingannare i regolatori all'interno della cellula ed essere estremamente difficile da definire con gli inibitori.
"La ricerca nel nostro laboratorio negli ultimi anni ha contribuito a stabilire un approccio diverso, uno che è stato teorizzato per molti anni ma che solo ora è pienamente realizzato da quest'ultimo lavoro. Invece di usare la piccola molecola per cercare di disabilitare la proteina cattiva, abbiamo sviluppato un modo per modificarlo in modo che possa essere utilizzato per attirare le proteine neutralizzanti, che poi si legano al loro cattivo prossimo e agiscono contro di esso, avviando un processo a cascata di degrado.
"In modo cruciale, abbiamo anche scoperto che non è sufficiente che questa proteina neutralizzante si sieda vicino alla proteina cattiva, deve entrare in contatto diretto con esso, per "baciarlo". E non solo un piccolo bacetto, ma un vero abbraccio "Via col vento". Lo chiamiamo "bacio della morte", poiché è la chiave per garantire la degradazione della proteina cattiva".
Il professor Ciulli e colleghi hanno concentrato la loro attenzione su una molecola chimica degradante bivalente chiamata "PROTAC" (molecole chimeriche mirate alla proteolisi). Sono stati in grado di creare la prima struttura cristallina a raggi X di un PROTAC legato sia alla proteina "cattiva" che all'agente "neutralizzante" (una ubiquitina ligasi E3). e hanno scoperto che può essere utilizzato con successo come un "magnete" per avvicinare le due proteine bersaglio.
"Questa scoperta fornisce le prime informazioni in assoluto su come funzionano i PROTAC e su come possiamo indirizzare le proteine per la degradazione in modo altamente selettivo, " disse il professor Ciulli.
"Questo presenta un cambiamento di paradigma nel modo in cui possiamo garantire un intervento chimico selettivo contro le proteine che sappiamo essere fattori causa di malattie ma che fino ad ora è stato impossibile prendere di mira con successo. Indica la possibilità di drogare il 'non drogabile'".
I risultati della ricerca sono pubblicati sulla rivista Natura chimica biologia .
Il lavoro svolto dal team di Dundee si è concentrato sull'abbinamento di una delle proteine del bromodominio BET, BRD4, che è un attraente bersaglio farmacologico per il cancro, con un "degradatore" selettivo BRD4 chiamato MZ1. Hanno scoperto che MZ1 potrebbe unire le due proteine ripiegandosi su se stessa. Una volta che le due proteine si sono unite nel loro "bacio", le interazioni tra di loro portano alla degradazione del bersaglio. Hanno mostrato come proteine simili BRD2 e BRD3 non baciano anche la proteina neutralizzante, e guidati da queste informazioni sono stati in grado di progettare nuovi degradatori che risparmiano completamente quelle proteine dal processo di degradazione. Questo è importante perché chiarisce come le molecole degradanti potrebbero essere progettate in futuro per ridurre al minimo gli effetti fuori bersaglio in modi che potrebbero non essere possibili usando gli inibitori convenzionali.
Il team di Dundee che lavorava al progetto includeva ricercatori post-dottorato nel laboratorio del professor Ciulli Morgan Gadd, Andrea Testa, Xavier Lucas e Kwok-Ho Chan, e Wengzhan Chan e Dougie Lamont del Dundee Fingerprints Proteomics Facility.
Il professor Ciulli ha affermato che ci sono già segnali promettenti dall'industria farmaceutica di investimenti significativi in questo settore di ricerca.
"Ora capiamo meglio come trasformare gli inibitori in degradanti. La strada per trasformare i degradatori in farmaci sarà lunga e tortuosa e non possiamo arrivarci da soli. È emozionante vedere segni di serio impegno da parte dell'industria farmaceutica, il che si aggiunge all'ottimismo sul fatto che saremo in grado di arrivare a un punto in cui possiamo drogare l'"indistruttibile"".