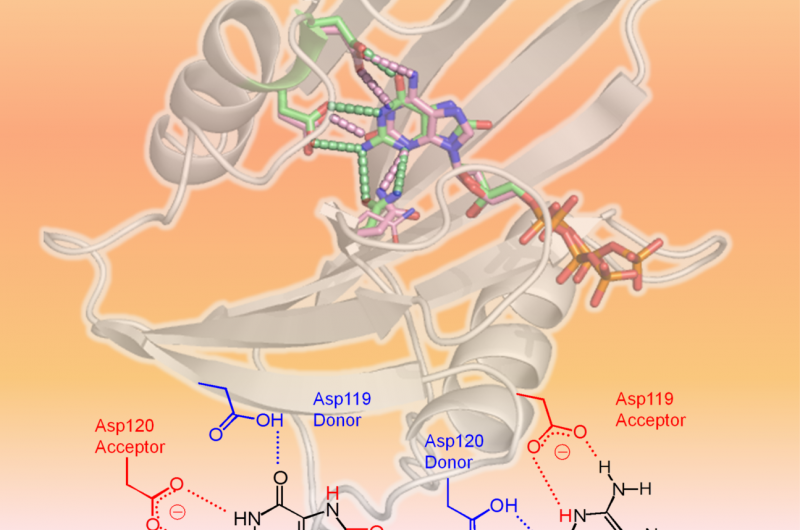
hMTH1 riconosce due dNTP ossidati come mostrato nella struttura 3-D (area superiore della figura:hMTH1, nastro; dNTP danneggiati, bastoni). Il fattore determinante nell'ampia specificità del substrato è il diverso stato di protonazione tra Asp-119 e Asp-120 (area inferiore della figura). Credito:Professor Yuriko Yamagata
La proteina umana MutT omologo 1 (hMTH1) agisce come enzima primario per scomporre (idrolizzare) i deossinucleosidi trifosfati (dNTP) danneggiati (ossidati) i substrati della sintesi del DNA. Recentemente, hMTH1 ha attirato l'attenzione come bersaglio popolare per nuove terapie antitumorali perché non è essenziale per le cellule normali, ma le cellule tumorali lo richiedono per evitare di incorporare nucleotidi ossidati nel DNA, che comporterebbe la morte delle cellule cancerose. Ora, Gli inibitori di hMTH1 sono sviluppati come candidati farmaci antitumorali. Anche se alcuni rapporti discutono contro l'utilità dell'inibizione di hMTH1, inibitori altamente potenti e selettivi di hMTH1, che consentirebbe l'introduzione di nucleotidi ossidati nel DNA delle cellule cancerose, sono attesi per il futuro trattamento del cancro.
Gli enzimi sono solitamente molto particolari riguardo al materiale che catalizzano (substrato). Alcuni, però, può catalizzare più di un substrato, e hMTH1 è noto per idrolizzare diversi dNTP ossidati. Le ragioni alla base dell'ampia specificità del substrato non erano ancora state esplorate quando i ricercatori giapponesi hanno iniziato a considerare il problema.
Scienziati dell'Università di Kumamoto, gli Istituti Nazionali di Scienze e Tecnologie Quantistiche e Radiologiche, e la Kyushu University hanno eseguito analisi strutturali e cinetiche su hMTH1 per determinare i meccanismi alla base della sua capacità di idrolizzare vari dNTP mutageni ossidati, come 8-oxo-dGTP e 2-oxo-dATP, con efficienza simile. I loro esperimenti hanno trovato prove che lo stato di protonazione tra i residui di aspartato Asp-119 e Asp-120 era il fattore determinante nell'ampia specificità del substrato di hMTH1. In altre parole, l'aggiunta o la rimozione di uno o più protoni in Asp-119 o Asp-120 è ciò che fa sì che hMTH1 riconosca 8-oxo-dGTP o 2-oxo-dATP. Ciò consente a hMTH1 di idrolizzare i dNTP mutageni ossidati prima che vengano utilizzati per la sintesi del DNA; Il DNA che contiene nucleotidi ossidati causerebbe la morte delle cellule cancerose.
"Abbiamo scoperto che diversi stati di protonazione tra Asp-119 e Asp-120 sono il segnale per hMTH1 di idrolizzare i nucleotidi danneggiati. Se questa azione di hMTH1 può essere soppressa, le cellule cancerose accumulerebbero nucleotidi danneggiati e alla fine andrebbero incontro ad apoptosi, ", ha affermato il professor Yuriko Yamagata dell'Università di Kumamoto, capogruppo del gruppo di ricerca. "Il chiarimento di questo meccanismo dovrebbe aiutare nello sviluppo di hMTH1 mirato ai farmaci antitumorali".