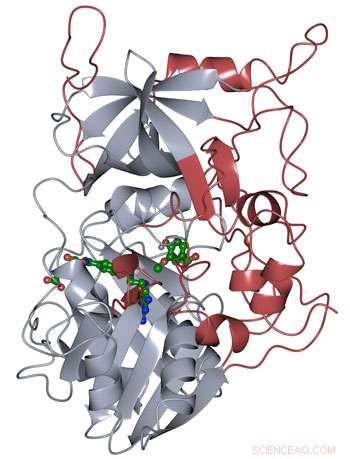
La struttura proteica di LigM è stata determinata mediante cristallografia a raggi X, rivelando nuovi elementi strutturali che sono unici per LigM (rosso) oltre a un dominio di legame al tetraidrofolato conservato (grigio) che si trova per tutta la vita. LigM si lega ai suoi substrati (verde) utilizzando cavità di legame interne. Credito:Amanda Kohler/JBEI
Una proteina utilizzata dai comuni batteri del suolo sta fornendo nuovi indizi nello sforzo di convertire i composti arilici, un comune prodotto di scarto delle pratiche industriali e agricole, in qualcosa di valore.
I ricercatori del Lawrence Berkeley National Laboratory (Berkeley Lab) del Department of Energy e dei Sandia National Laboratories che lavorano presso il Joint BioEnergy Institute (JBEI) hanno risolto la struttura proteica dell'enzima LigM, che viene utilizzato dal batterio del suolo Sphingomonas per metabolizzare i composti arilici derivati dalla lignina, il rigido, materiale organico che conferisce alle piante la loro struttura.
Il loro lavoro è riportato oggi nel Atti dell'Accademia Nazionale delle Scienze .
Nella produzione di biocarburanti, i composti arilici sono un sottoprodotto della scomposizione della lignina. Molte delle vie che portano alla degradazione della lignina coinvolgono la demetilazione, che è spesso un precursore critico per eventuali passaggi aggiuntivi nella modifica dei composti arilici derivati dalla lignina.
L'autrice principale dello studio Amanda Kohler, Ricercatore post-dottorato JBEI presso Sandia, notato che LigM è un'attraente demetilasi per l'uso nella conversione aromatica perché è un semplice, sistema a singolo enzima. LigM è anche in grado di mantenere la sua funzionalità in un ampio intervallo di temperature.
"Quando stiamo cercando di costruire nuovi percorsi nella biologia sintetica, più semplice è il sistema meglio è, " ha detto Kohler.

La ricercatrice post-dottorato Amanda Kohler imposta le reazioni enzimatiche come parte del gruppo di ottimizzazione enzimatica di JBEI. Credito:Marilyn Chung/Berkeley Lab
I ricercatori hanno scoperto che metà dell'enzima LigM era omologa a strutture note con un dominio di legame al tetraidrofolato che si trova sia negli organismi semplici che in quelli complessi. L'altra metà della struttura di LigM è completamente unica, fornendo un punto di partenza per determinare dove si trova il suo sito di legame al substrato arilico. Hanno anche scoperto che LigM è una demetilasi tirosina-dipendente.
"È il primo del suo genere ad essere identificato, " ha detto Kohler. "Questa ricerca fornisce le basi tanto necessarie per aiutare nello sviluppo di un sistema basato su enzimi per convertire i prodotti di scarto aromatici in qualcosa di utile".
Kohler ha affermato che ora stanno lavorando all'ingegneria LigM in modo che sia in grado di agire su una gamma più ampia di substrati arilici oltre a prendere di mira specifici prodotti di scarto arilici.