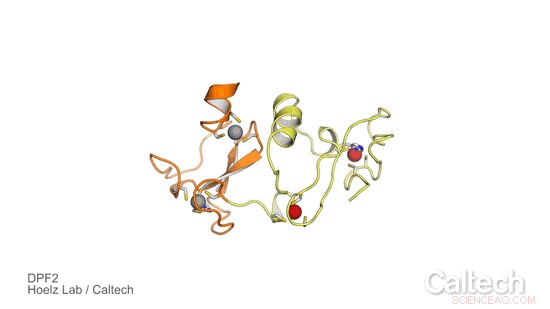
Una struttura cristallina di una porzione di DPF umano2, una proteina che controlla un interruttore genetico che dice alle cellule staminali del sangue quando diventare globuli rossi e globuli bianchi. Le regioni arancioni e gialle illustrano il dominio 'lettore' DPF2, stabilizzato dagli ioni di zinco, rappresentati come sfere rosse e grigie. Credito:Hoelz Lab/Caltech
Molte cose vanno storte nelle cellule durante lo sviluppo del cancro. Al centro del caos ci sono spesso interruttori genetici che controllano la produzione di nuove cellule. In una forma particolarmente aggressiva di leucemia, chiamata leucemia mieloide acuta, un interruttore genetico che regola la maturazione delle cellule staminali del sangue in globuli rossi e bianchi va storto. Normalmente, questo interruttore porta a un numero appropriato di globuli bianchi e rossi. Ma i pazienti con leucemia mieloide acuta finiscono con un pericoloso accumulo di cellule staminali del sangue e una mancanza di globuli rossi e bianchi, cellule necessarie per fornire ossigeno al corpo e combattere le infezioni.
Ora, i ricercatori del Caltech e del Sylvester Comprehensive Cancer Center dell'Università di Miami si stanno concentrando su una proteina che aiuta a controllare questo interruttore genetico. Negli individui sani, la proteina, chiamato DPF2, interrompe la produzione di globuli rossi e bianchi quando non è necessario sostituirli. Questo è, spegne l'interruttore. Ma la proteina può essere iperprodotta nei pazienti con leucemia mieloide acuta. La proteina si trova fondamentalmente sull'interruttore, impedendogli di riaccendersi per produrre le cellule del sangue secondo necessità. I pazienti che producono DPF2 in eccesso hanno una prognosi particolarmente sfavorevole.
In un nuovo studio, da pubblicare la settimana del 22 maggio, 2017, nel diario Atti dell'Accademia Nazionale delle Scienze , i ricercatori dimostrano nuovi modi per impedire DPF2, potenzialmente rendendo la leucemia mieloide acuta più curabile. Riportano nuovi dettagli strutturali e funzionali su un frammento di DPF2. Queste nuove informazioni rivelano obiettivi per lo sviluppo di farmaci che bloccherebbero la funzione della proteina.
"Molte malattie umane, compresi i tumori, insorgono a causa di interruttori genetici malfunzionanti, "dice André Hoelz, il corrispondente autore dello studio. Hoelz è professore di chimica al Caltech, un investigatore dell'Heritage Medical Research Institute (HMRI), e uno studioso di facoltà dell'Howard Hughes Medical Institute (HHMI). "Spiegare come funzionano al dettaglio atomico ci consente di iniziare il processo di personalizzazione dei farmaci per inattivarli e in molti casi questo è un passo significativo verso una cura".
I globuli rossi e bianchi vengono costantemente rigenerati dalle cellule staminali del sangue, che risiedono nel nostro midollo osseo. Come altre cellule staminali, le cellule staminali del sangue possono vivere per sempre. È solo quando si differenziano in tipi cellulari specifici, come globuli rossi e bianchi, che poi diventano mortali, o acquisire la capacità di morire dopo un certo periodo di tempo.
"I nostri corpi utilizzano una serie complessa di interruttori genetici per differenziare una cellula staminale del sangue in molti tipi di cellule differenti. Queste cellule differenziate poi circolano nel sangue e svolgono una varietà di funzioni diverse. Quando queste cellule raggiungono la fine della loro vita hanno bisogno di essere rimpiazzato, " dice Hoelz. "Questo è un po' come sostituire le gomme usate su un'auto".
Per studiare il ruolo di DPF2 e saperne di più su come controlla l'interruttore genetico per la produzione di cellule del sangue, il gruppo Hoelz ha collaborato con Stephen D. Nimer, co-autore corrispondente dell'articolo e direttore del Sylvester Comprehensive Cancer Center, e la sua squadra. Primo, Ferdinand Huber e Andrew Davenport, entrambi studenti laureati al Caltech nel gruppo Hoelz e co-autori del nuovo studio, hanno ottenuto cristalli di una porzione della proteina DPF2 contenente un dominio noto come dito PHD, che sta per pianeta omeodominio. Hanno quindi usato la cristallografia a raggi X, un processo che comporta l'esposizione di cristalli proteici a raggi X ad alta energia, per risolvere la struttura del dominio finger PHD. La tecnica è stata eseguita presso la Stanford Synchrotron Radiation Lightsource, utilizzando una linea di luce dedicata dell'Osservatorio molecolare del Caltech.
I risultati hanno rivelato come DPF2 si leghi a un complesso DNA-proteina, chiamato nucleosoma, per bloccare la produzione di globuli rossi e bianchi. La proteina "legge" vari segnali visualizzati sulla superficie del nucleosoma adottando una forma che si adatta a varie modifiche sul complesso del nucleosoma, come i pezzi di forma diversa di un puzzle. Una volta che la proteina si lega a questo locus del DNA, DPF2 spegne l'interruttore che regola la differenziazione delle cellule del sangue.
Il passo successivo era vedere se DPF2 poteva essere bloccato nelle cellule staminali del sangue umano in laboratorio. Sarah Greenblatt, un associato post-dottorato nel gruppo di Nimer e co-primo autore dello studio, ha usato le informazioni strutturali del gruppo di Hoelz per creare una versione mutata della proteina. Il gruppo Nimer ha poi introdotto la proteina mutata nelle cellule staminali del sangue, e ha scoperto che il DPF2 mutato non poteva più legarsi al nucleosoma. In altre parole, DPF2 non poteva più disattivare l'interruttore per la produzione di cellule del sangue.
"Il DPF2 mutato non è stato in grado di legarsi a regioni specifiche del genoma e non ha potuto fermare la differenziazione delle cellule staminali del sangue, ", afferma Huber. "Resta da vedere se DPF2 può essere bloccato anche negli stessi malati di cancro". una delle regioni simili a pezzi di puzzle identificate nel nuovo studio, è un buon obiettivo per i farmaci candidati.