Credito:Istituto di chimica bioorganica dell'Accademia delle scienze russa
Scienziati russi riferiscono che l'enzima fosfolipasi A2 del veleno di Vipera nikolskii è in grado di aderire alle membrane lipidiche e provocarne l'aggregazione, anche se l'attività dell'enzima è specificamente bloccata. Ciò è dovuto alla presenza di due siti di legame nella struttura dell'enzima. Pubblicato sulla rivista tossico , i risultati aiutano a capire come funzionano i veleni di serpente multicomponente.
Alcuni animali evitano il pericolo con l'aiuto del camuffamento, altri con artigli, denti o zoccoli. E alcuni insetti, ragni, scorpioni e serpenti hanno veleni che non solo possono paralizzare, ma anche uccidere l'attaccante. Molti ricercatori sono interessati ai complessi componenti del veleno, perché possono essere usati per produrre antidoti e creare nuovi farmaci. I veleni contengono neurotossine, veleni che agiscono sul sistema nervoso e bloccano la conduzione degli impulsi nervosi. Queste neurotossine includono alcuni tipi di enzima fosfolipasi A2.
L'interesse dei ricercatori per la fosfolipasi A2 è dovuto al fatto che funge da marker di infiammazione. Ciò significa che il livello di questo enzima nel sangue aumenta con l'infiammazione acuta nel corpo. Perciò, diversi gruppi scientifici internazionali stanno cercando di creare sistemi per rilevare l'attività della fosfolipasi A2.
Nel 2016, i ricercatori del Laboratorio di chimica dei lipidi di IBCh RAS hanno sviluppato un metodo di fluorescenza fondamentalmente nuovo per rilevare l'interazione di questo enzima con un doppio strato molecolare di lipidi (il cosiddetto doppio strato lipidico) - la struttura di base della membrana cellulare. Il metodo si basa sul trasferimento di energia tra due coloranti fluorescenti (fluorofori attaccati alle molecole di fosfolipidi) incorporati nel doppio strato lipidico.
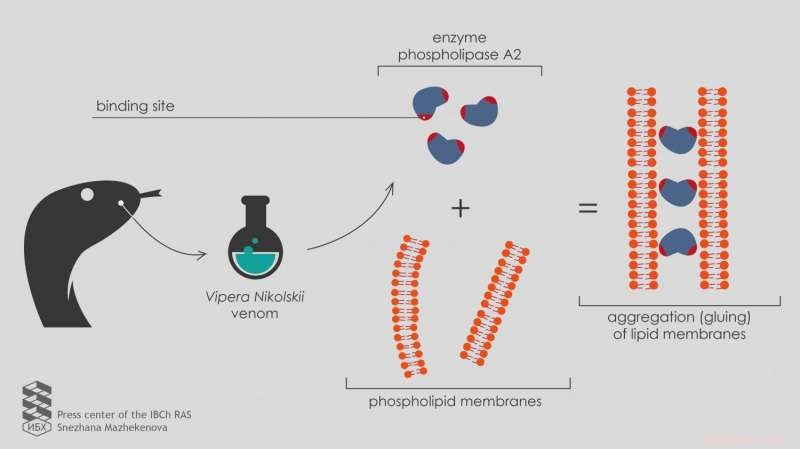
"Per testare il nuovo sviluppo su quanti più campioni possibile, ci siamo rivolti al Laboratorio di Tossina Molecolare IBCh RAS, "dice Ivan Boldyrev, un ricercatore senior presso il Laboratorio di chimica dei lipidi. "Il capo del laboratorio, Yuri Utkin, ha raccolto una serie di fosfolipasi A2 da veleni di vari organismi, incluse due fosfolipasi eterodimeriche A2 dal veleno di Vipera nikolskii. Ciascuno di questi enzimi è costituito da due subunità eterofunzionali, catene polipeptidiche ripiegate in modo specifico. Però, il meccanismo dell'effetto tossico di questi eterodimeri non è chiaro."
La ricerca ha prodotto risultati inaspettati. Sotto l'azione di queste "doppie proteine" (eterodimeri), la fluorescenza non si è verificata, come con tutte le altre fosfolipasi, ma invece decaduto.
Uno studio più approfondito utilizzando la microscopia elettronica ha mostrato che le fosfolipasi eterodimeriche A2 del veleno di Vipera nikolskii hanno causato l'aggregazione delle membrane lipidiche, nel senso che li incollano insieme. Però, questo effetto è emerso solo con membrane caricate negativamente.
"Le membrane non cariche senza carica elettrica sulla superficie non si combinano sotto l'azione di eterodimeri, " spiega Anna Alekseeva, a junior researcher at the Laboratory of Lipid Chemistry.
"We managed to establish the specificity of heterodimeric phospholipases A2 for negatively charged membranes and determined pH conditions of the medium at which the enzyme manifests itself, " says DariaTretyakova, un dottorato di ricerca student at the Laboratory of Lipid Chemistry.
The new data will help to understand the effect of multicomponent snake venoms, and the developed methodology will be in demand for studying other lipid-protein interactions.