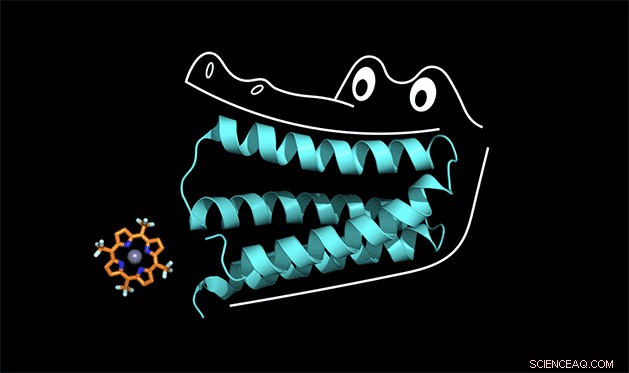
La proteina sintetica blocca la porfirina come le fauci di un alligatore. Credito:Nicholas Polizzi
Le proteine hanno il potere di mettere in moto le reazioni biochimiche all'interno del corpo.
Senza l'aiuto di tipi di proteine chiamate enzimi, la reazione che costruisce il DNA potrebbe impiegare più di 130, 000 anni da completare. Gli enzimi riducono questo tempo a pochi millisecondi.
Per accelerare le reazioni chimiche, molte proteine si alleano con molecole o metalli più piccoli chiamati cofattori. I chimici vorrebbero progettare proteine che si legano a cofattori non biologici per accelerare reazioni chimiche non presenti in natura. Ma prima, devono capire come creare proteine artificiali che si leghino a nuovi cofattori esattamente nel modo giusto, e non è un'impresa facile.
Un team di chimici della Duke e dell'UC San Francisco è il primo a risolvere questo enigma sulla progettazione delle proteine. Il team ha creato una proteina sintetica che lega strettamente un catalizzatore non biologico, un tipo di molecola chiamata porfirina che è in grado di sottrarre elettroni ad altre molecole quando assorbe la luce.
"Essere in grado di combinare catalizzatori prodotti dall'uomo con proteine sarebbe davvero importante nel campo della chimica perché in tal caso potresti combinare il potere di un enzima con quello di una reazione che non si trova in natura, " ha detto l'ex studente laureato del Duca Nicholas Polizzi, che ora è ricercatore post-dottorato nel laboratorio di William DeGrado alla UCSF.
"Siamo stati in grado di capire i criteri di progettazione necessari per posizionare quella porfirina in una proteina con una precisione molto elevata, " ha detto Polizzi. "Questo è stato davvero un grande trampolino di lancio per essere in grado di progettare nuove combinazioni proteina-cofattore non viste in natura".
Le proteine sono costituite da catene di centinaia o migliaia di amminoacidi più piccoli che si attorcigliano e si avvolgono in complesse forme 3D che possono intrecciarsi con altre molecole come pezzi di un puzzle. Per catalizzare le reazioni chimiche, le combinazioni proteina-cofattore tengono due o più molecole in tasche dalla forma precisa che mantengono le molecole nelle giuste posizioni, e fornire il giusto ambiente, perché avvenga una reazione chimica.
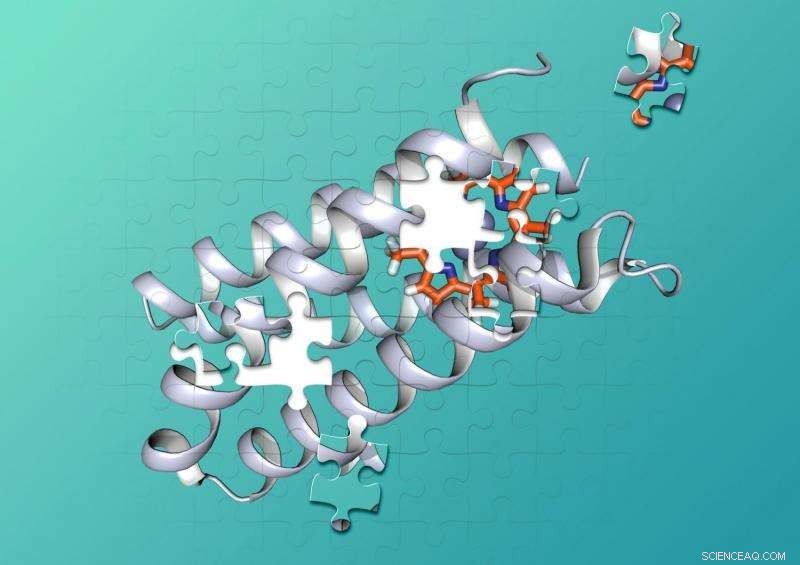
I chimici della Duke e dell'UCSF hanno progettato una proteina sintetica che lega strettamente una molecola non biologica. Credito:Nicholas Polizzi
Milioni di anni di evoluzione hanno creato proteine che si piegano in forme che aderiscono saldamente a specifici cofattori e forniscono gli ambienti perfetti per catalizzare le reazioni chimiche.
Da oltre 25 anni, i chimici hanno usato ciò che sanno sul ripiegamento delle proteine per progettare sequenze di amminoacidi sintetici che si attorcigliano in forme utili. Ma così lontano, non sono stati in grado di progettare una proteina che leghi un cofattore non biologico con la precisione necessaria per alimentare nuove complesse reazioni chimiche.
Polizzi ha affermato che ciò potrebbe essere dovuto al fatto che questi progetti si concentravano principalmente sul "sito di legame" in cui i cofattori e le molecole reattive si inseriscono nella proteina, ignorando il resto della struttura. "Quello che ho fatto diversamente è che ho considerato essenzialmente l'intero interno della proteina come sito di legame per la porfirina, al contrario di pochi amminoacidi che toccano la porfirina, " ha detto Polizzi.
Per capire come funziona, puoi pensare alla proteina come alla bocca di un alligatore, disse Michael Therien, William R. Kenan Jr. Professore di chimica alla Duke. La proteina si attacca a un cofattore nello stesso modo in cui un alligatore usa i suoi denti anteriori per masticare la cena. Ma per i denti anteriori per ottenere una presa forte, anche la mascella e i denti posteriori devono essere progettati correttamente.
"Il nuovo concetto qui è che la regione non legante della proteina è mantenuta in una forma che consente alla regione legante di funzionare, " disse Terien.
"Abbiamo chiamato la proteina 'gator' in laboratorio, " ha detto Polizzi.
Le fauci della proteina alligatore in realtà stringono così forte il cofattore di porfirina che l'intera struttura è troppo rigida per catalizzare una reazione, ha detto Polizzi. Ma con alcune modifiche per allentare la struttura, pensa di poterlo far funzionare.
"In questa reazione, spesso hai bisogno di un po' di spazio di manovra nella proteina perché si muova. E non c'era spazio di manovra nelle nostre proteine, tutto si adattava troppo perfettamente, " ha detto Polizzi.