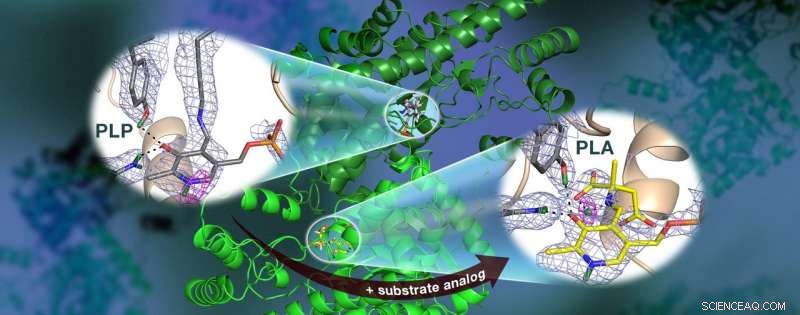
Un team guidato dall'ORNL ha usato i neutroni per osservare l'enzima AAT, una proteina dipendente dalla vitamina B6, e ha scoperto che la reazione chimica si è verificata solo in un sito attivo. Le mappe di densità della lunghezza di scattering nucleare (maglia colorata) evidenziano le posizioni degli atomi di idrogeno critici, compreso un legame idrogeno a bassa barriera (magenta mesh) che non si ritiene esista in AAT, che può essere cruciale per la catalisi. Credito:Jill Hemman e Andrey Kovalevsky /Oak Ridge National Laboratory, Dipartimento dell'Energia degli Stati Uniti
Gli scienziati dell'Oak Ridge National Laboratory del Department of Energy hanno eseguito l'analisi strutturale dei neutroni di una proteina dipendente dalla vitamina B6, potenzialmente aprendo strade a nuovi antibiotici e farmaci per combattere malattie come la tubercolosi resistente ai farmaci, malaria e diabete.
Nello specifico, il team ha utilizzato la cristallografia di neutroni per studiare la posizione degli atomi di idrogeno nell'aspartato aminotransferasi, o AAT, un enzima vitale per il metabolismo di alcuni amminoacidi.
"Abbiamo visualizzato la prima struttura di neutroni di un enzima della vitamina B6 che appartiene a una grande famiglia di proteine con centinaia di membri che esistono in natura, " ha detto Andrey Kovalevsky di ORNL, un co-autore senior dello studio, che è stato pubblicato su Nature Communications.
Le proteine dipendenti dalla vitamina B6 fanno parte di un gruppo eterogeneo di enzimi che conducono oltre un centinaio di diverse reazioni chimiche nelle cellule. Gli enzimi sono di interesse biomedico, così come la bioenergia, ricercatori a causa del loro ruolo nel metabolizzare gli amminoacidi e altri nutrienti cellulari.
"Questi enzimi sono unici in quanto ognuno esegue una specifica reazione chimica con squisita precisione, sopprimendo altre trasformazioni chimiche vitali, " ha detto Kovalevsky. "Come ottengano questo non è ben compreso, ma è di grande importanza per la progettazione di farmaci".
La precedente ricerca del team aveva previsto che gli atomi di idrogeno si muovessero all'interno e intorno al sito attivo dell'enzima, dove avviene la reazione chimica, indicando che il posizionamento degli atomi di idrogeno controlla il tipo di reazione. Conoscere la posizione precisa degli atomi di idrogeno può spiegare perché il comportamento di questi enzimi è così specifico, ma l'idrogeno è difficile da rilevare con metodi standard come la cristallografia a raggi X.
Per determinare direttamente le posizioni degli atomi di idrogeno all'interno dell'AAT, il team guidato dall'ORNL si è rivolto alle tecniche di diffrazione dei neutroni. I ricercatori hanno esposto delicati cristalli proteici ai neutroni utilizzando la linea di luce IMAGINE presso il reattore ad isotopi ad alto flusso dell'ORNL e la linea di luce LADI-III presso l'Institut Laue-Langevin di Grenoble, Francia.
Sorprendentemente, il team ha osservato una reazione all'interno di una biomolecola proteica AAT mentre un'altra biomolecola AAT era invariata, fornendo una prospettiva prima e dopo della reazione chimica catalizzata da enzimi.

Steven Dajnowicz (a sinistra) e Andrey Kovalevsky dell'ORNL hanno preparato un campione per iniziare l'analisi strutturale dei neutroni di una proteina dipendente dalla vitamina B6 utilizzando la linea di luce IMAGINE presso l'High Flux Isotope Reactor dell'ORNL. I risultati dello studio potrebbero aprire nuove strade a nuovi antibiotici e farmaci per combattere le malattie. Credito:Genevieve Martin/Oak Ridge National Laboratory, Dipartimento dell'Energia degli Stati Uniti
"I dati hanno rivelato che in una delle strutture biomolecolari dell'enzima i legami covalenti si sono riorganizzati dopo una reazione chimica avvenuta nel sito attivo e, in un altro, la reazione non era avvenuta, " ha detto Kovalevsky. "Essenzialmente, siamo riusciti ad ottenere due strutture in un cristallo, che non è mai stato fatto prima per nessuna proteina che utilizza neutroni."
Con questa conoscenza, il team eseguirà simulazioni molecolari per determinare il comportamento specifico degli atomi di idrogeno quando interagiscono con l'enzima. I risultati potrebbero essere utili per guidare la progettazione futura di nuovi farmaci contro la tubercolosi multiresistente, malaria, diabete e batteri resistenti agli antibiotici.
"Questo studio evidenzia come i neutroni siano una sonda senza rivali per identificare la posizione degli atomi di idrogeno nei sistemi biologici, fornendoci un livello di dettaglio strutturale senza precedenti per questo importante enzima, "Ha detto lo scienziato della linea di luce LADI-III Matthew Blakeley.