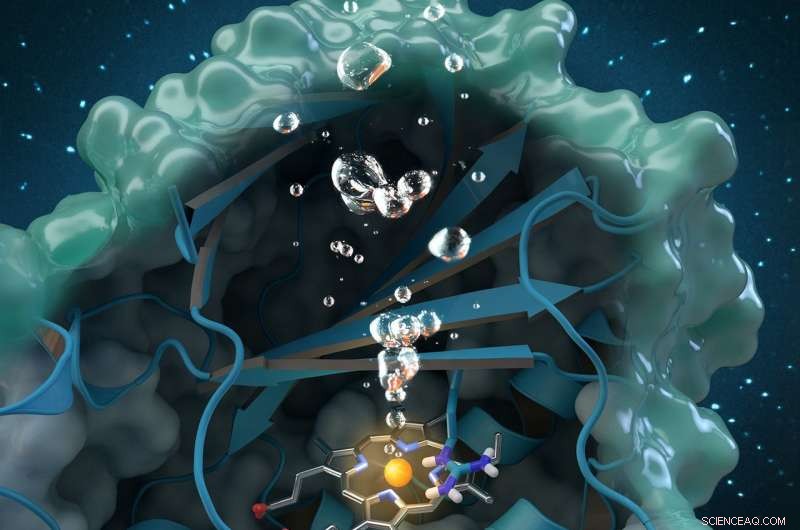
La clorito dismutasi è un enzima generatore di ossigeno unico che degrada la clorite, un inquinante industriale presente a livello globale nelle acque sotterranee, acqua potabile e suolo. La ricerca condotta presso l'ORNL contribuisce a un'analisi strutturale e biochimica completa dell'enzima, aprendo la strada a future applicazioni ambientali. Credito:copertina della rivista ristampata con il permesso di Catalisi ACS , vol. 7, numero 11, 3 novembre 2017.
Un nuovo studio fa luce su un enzima unico che potrebbe fornire un trattamento ecologico per le forniture di acqua contaminata da clorito e migliorare la qualità dell'acqua in tutto il mondo.
Un team internazionale di ricercatori guidati da Christian Obinger dell'Università di Vienna ha utilizzato l'analisi dei neutroni presso l'Oak Ridge National Laboratory, Cristallografia a raggi X e altre tecniche per lo studio dell'enzima clorito dismutasi. Questa proteina naturale può scomporre il clorito, un inquinante industriale presente nelle acque sotterranee, acqua potabile e suolo, in sottoprodotti innocui, ma il suo processo catalitico non è ben compreso. Comprendere come l'enzima batterico converte la clorite in cloruro e ossigeno potrebbe aprire possibilità per future applicazioni nel biorisanamento e nella biotecnologia.
I risultati, pubblicato in Catalisi ACS , contribuiscono anche alla ricerca fondamentale sulla capacità dell'enzima di produrre ossigeno. La generazione di ossigeno è incredibilmente rara in natura, una volta ritenuto possibile solo dalla fotosintesi, quindi l'attività enzimatica della clorito dismutasi ha attirato l'interesse della comunità scientifica al di là delle sue applicazioni ambientali per l'acqua pulita.
Il modo esatto in cui la clorito dismutasi agisce a livello molecolare per scomporre la clorite è stato discusso da quando l'enzima è stato scoperto nel 1996. La complessità della struttura molecolare dell'enzima e la difficoltà di studiare le proteine con metodi sperimentali presentano sfide intrinseche per i ricercatori.
Come la maggior parte degli enzimi, la clorito dismutasi è una proteina che catalizza una reazione altamente specifica. Il processo è spesso dipendente dall'ambiente, il che significa che funziona meglio entro parametri specifici, compresa la temperatura, concentrazione e range di pH. L'identificazione dei parametri ideali per la reazione è fondamentale per supportare la bioingegneria e la produzione su larga scala di clorito dismutasi per rimuovere in sicurezza la clorite dall'ambiente e sfruttare potenzialmente la generazione di ossigeno dell'enzima.
Il team ha isolato un ceppo Cyanothece di clorite dismutasi non studiato ed ha esaminato la struttura cristallina della proteina a valori di pH specifici per determinare l'impatto del pH sulla conversione della clorite.
I ricercatori hanno utilizzato ManDi, il diffrattometro macromolecolare a neutroni, linea di luce 11-B alla Spallation Neutron Source, una struttura per gli utenti del Dipartimento dell'energia presso l'ORNL, raccogliere dati univoci ottenibili solo attraverso l'uso di neutroni.
"Diversi cristalli di proteine hanno diversi gradi di simmetria, che determinerà come andremo a misurarli. Questo cristallo è insolito in quanto ha pochissima simmetria, quindi un numero particolarmente elevato di riflessioni deve essere registrato individualmente per ottenere un set di dati completo, " disse Leighton Coates, Scienziato capo dello strumento ManDi. "Sarebbe un compito lungo e impegnativo ovunque, ed era realizzabile solo in questo lasso di tempo a causa dell'ampia copertura del rivelatore dell'area dello strumento MaNDi."
Su ManDi, i ricercatori sono stati in grado di rilevare gli stati di protonazione di importanti amminoacidi pensati per supportare la reazione. "Protonazione" si riferisce a una fase fondamentale della catalisi durante la quale l'idrogeno si attacca alle molecole. "Questa è la regione importante della proteina, dove avviene la chimica e la clorite viene scomposta, " disse Coates.
Gli stati di protonazione non sono facilmente osservabili perché coinvolgono idrogeno, che è difficile da rilevare con i raggi X o altre tecniche. Inoltre, un fenomeno chiamato "fotoriduzione" si verifica quando si espongono ai raggi X enzimi contenenti metalli come la clorite dismutasi, modificando sostanzialmente la struttura atomica del campione.
Poiché le tecniche di neutroni non hanno queste limitazioni, possono fornire ai ricercatori informazioni chiave che non possono essere ottenute con altri metodi. "I neutroni sono non distruttivi e sensibili agli elementi leggeri come l'idrogeno, in modo che possano fornire informazioni esclusive sulla struttura atomica delle proteine, che sono in gran parte composti da molecole di idrogeno, "ha spiegato Coates.
"E a differenza dei raggi X che possono danneggiare le proteine delicate, le tecniche di neutroni consentono di raccogliere dati a temperatura ambiente su una proteina inalterata nel suo stato attivo senza gli impatti delle radiazioni ionizzanti e della fotoriduzione, " ha detto Coates. "Questo esperimento evidenzia davvero il vantaggio dell'uso dei neutroni per studiare le proteine".