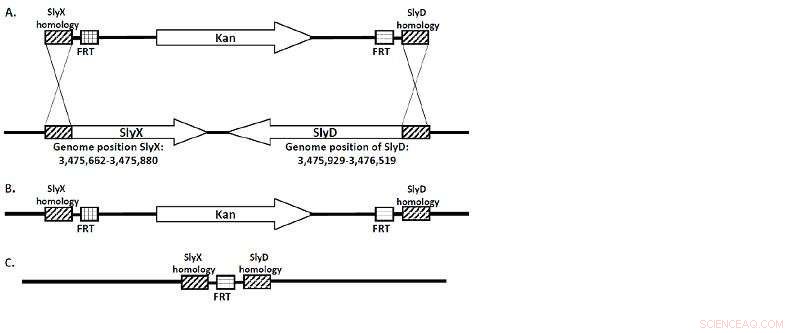
(A) La cassetta KanR fiancheggiata da regioni omologhe SlyX e SlyD. (B) L'intera sequenza di questi geni viene sostituita dalla cassetta KanR durante la ricombinazione. (C) La "cicatrice FRT" è tutto ciò che rimane una volta che il ceppo è "curato" dalla flp-ricombinasi. Credito:Università Lobachevsky
I sistemi batterici sono alcune delle piattaforme più semplici ed efficaci per l'espressione di proteine ricombinanti. Sono più convenienti rispetto ad altri metodi, e sono quindi di grande interesse non solo per i ricercatori della Lobachevsky University, ma anche per i produttori di farmaci importanti dal punto di vista terapeutico.
Però, oltre alle proteine ricombinanti bersaglio, le cellule producono anche un gran numero di proteine endogene, compreso SlyD. È una piccola proteina costituita da tre domini. La sua regione C-terminale è ricca di residui di istidina, e SlyD mostra quindi un'elevata affinità per gli ioni 2-valenti e viene purificato insieme alle proteine bersaglio nel corso della cromatografia di affinità con i metalli. Ciò si traduce nella necessità di ulteriori passaggi di purificazione, e di conseguenza, aumenta il costo del processo tecnologico per ottenere proteine ricombinanti terapeutiche.
Un team di ricercatori dell'Università Lobachevsky guidato dal professor Viktor Novikov, Direttore del Centro UNN di Biologia Molecolare e Biomedicina, ha ottenuto una serie di ceppi di E. coli carenti dei geni SlyD/SlyX. I ceppi sono stati ingegnerizzati utilizzando la delezione cromosomica mediata da -rosso. (Figura 1.)
"La sequenza di SlyD/SlyX nel genoma di E. coli è stata sostituita da un gene responsabile della resistenza all'antibiotico kanamicina che è stato affiancato su entrambi i lati da siti FRT, da dove è stato successivamente rimosso dalla ricombinasi FLP, "Note di Viktor Novikov.
Utilizzando l'esempio della proteina bispecifica ricombinante MYSTI-2 costituita da due moduli che sono centri attivi di anticorpi contro le proteine murine F4/80 e TNF, gli scienziati hanno confrontato l'attività delle proteine isolate dai ceppi originali e mutanti. Come risultato dello studio, è stato determinato che la rimozione dal genoma di E. coli dei geni SlyD e SlyX, che presumibilmente codificano chaperon che supportano la struttura spaziale delle proteine di Escherichia coli, non provoca un'interruzione dell'attività funzionale delle proteine ricombinanti.
Ottenendo ceppi originali di E. coli, i ricercatori sono stati in grado di risolvere il problema della contaminazione delle proteine ricombinanti e di garantire la loro purificazione in un unico stadio mediante cromatografia ad affinità con i metalli.
"L'insieme ottenuto di ceppi di E. coli carenti di slyD/slyX può essere utilizzato per produrre in forma pura un'ampia gamma di proteine procariotiche ed eucariotiche, comprese le proteine terapeutiche mediche. Ciò facilita lo sviluppo e la produzione di nuovi preparati medicinali e biologici preventivi, più semplice ed economico, " conclude Viktor Novikov.