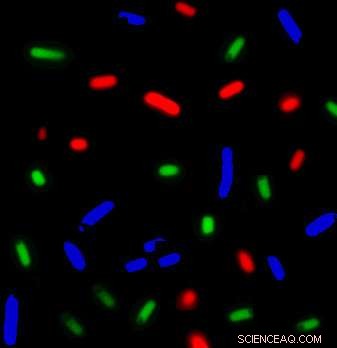
Queste E. coli i batteri etichettati con colori diversi producevano diverse miscele di proteine. Insieme, il consorzio batterico produce tutte le proteine necessarie per la traduzione/sintesi proteica dell'mRNA. Il nuovo metodo sviluppato all'UC Davis potrebbe accelerare lo sviluppo di sistemi biologici privi di cellule. Credito:Fernando Villarreal, UC Davis
Una nuova tecnica sviluppata presso l'UC Davis potrebbe aver infranto la barriera al rapido assemblaggio del meccanismo di sintesi proteica pura al di fuori delle cellule viventi.
Al fine di ricostituire le reazioni cellulari al di fuori dei sistemi biologici, gli scienziati devono produrre le proteine coinvolte. La ricostituzione rapida ma allo stesso tempo di elevata purezza delle reazioni cellulari è fondamentale per lo studio ad alto rendimento dei percorsi cellulari e per i test diagnostici privi di cellule per varie malattie. Ricostituente le reazioni cellulari al di fuori delle cellule, però, richiede l'espressione e la purificazione separate di ciascuna proteina necessaria per eseguire le reazioni. Questo processo è costoso e richiede tempo, rendendo la produzione di più di diverse proteine contemporaneamente estremamente impegnativa.
In un articolo pubblicato su Natura chimica biologia , Fernando Villarreal e i colleghi del laboratorio del professor Cheemeng Tan presso il Dipartimento di ingegneria biomedica della UC Davis descrivono la produzione in una singola coltura di tutte le 34 proteine necessarie per la traduzione dell'mRNA, il processo di sintesi di proteine dal codice genetico, nelle proporzioni corrette.
Attualmente, le proteine vengono estratte da cellule intere e utilizzate direttamente per la traduzione in vitro. Le proteine estratte con questo metodo possono contenere citoplasma e altri elementi della cellula originale, e sono indesiderabili per alcune applicazioni. Un altro metodo prevede la purificazione di ciascuna delle 34 proteine separatamente e la loro miscelazione per approssimare la miscela, o "macchine", necessario per avviare la traduzione dell'mRNA.
Il laboratorio Tan ha aggirato queste limitazioni ingegnerizzando sinteticamente ceppi di batteri Escherichia coli per produrre le proteine necessarie della quantità corretta all'interno di una singola coltura mista. Manipolando i tassi di trascrizione, velocità di traduzione e relative densità di deformazione, il gruppo ha scoperto che potevano indurre i consorzi batterici a produrre quantità corrette del macchinario di traduzione.
"Credo che il lavoro aprirà le porte a un miglioramento fondamentale della resa proteica dei sistemi di trascrizione-traduzione privi di cellule e del rendimento dello studio dei percorsi rilevanti per la malattia al di fuori delle cellule viventi, " disse Tan.
Il team chiama il loro metodo TraMOS, per macchine di traduzione One Shot. Hanno usato le proteine prodotte da TraMOS in un test che controlla la presenza di peptidi che inibiscono una proteasi. Poiché le proteasi sono comunemente coinvolte nel ciclo di vita dei parassiti e nello sviluppo del cancro, un test in grado di localizzare e identificare molti degli inibitori della proteasi tutti in una volta sarà utile per lo sviluppo di farmaci.
Riducendo i tempi e i costi associati alla preparazione di sistemi multiproteici, l'approccio del laboratorio Tan consente applicazioni ad alto rendimento di TraMOS senza dover investire in apparecchiature di purificazione aggiuntive. A differenza degli approcci esistenti, gli scienziati possono personalizzare l'espressione e il controllo delle proteine utilizzando l'approccio TraMOS. La maggior parte dei laboratori che eseguono regolarmente la purificazione delle proteine dispone già dell'attrezzatura per utilizzare l'approccio TraMOS, rendendolo facile da implementare, e democratizzare l'accesso al sistema. L'approccio basato sui consorzi microbici può essere generalizzato per la sintesi di altri sistemi multiproteici, rendendolo un potenziale punto di svolta per le applicazioni cell-free ad alto rendimento.