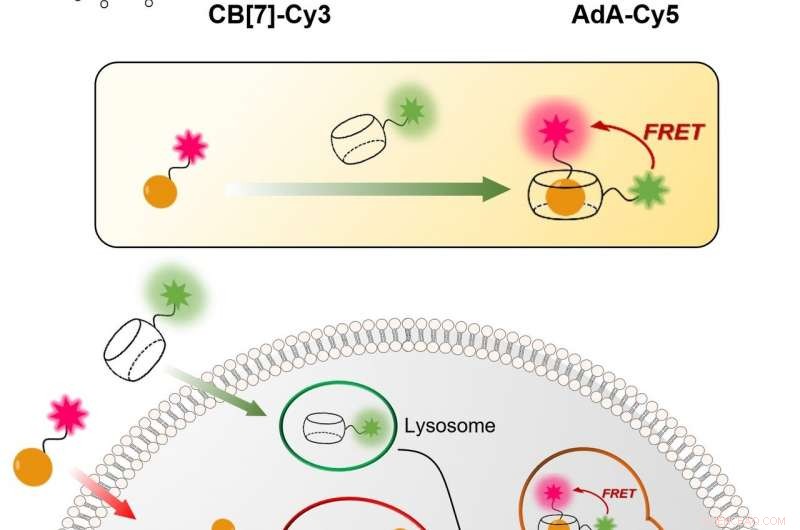
Figura 1:tecnica relativamente semplice ed economica per visualizzare il meccanismo di riciclo cellulare (autofagia) in tempo reale. Il processo si basa sul legame tra CB[7] e AdA. CB[7] è legato al colorante fluorescente Cy3 (colorato in verde) ed entra nei lisosomi, mentre AdA è legato alla Cy5 fluorescente (colorata in rosso) che si accumula nei mitocondri. Nel processo di autofagia, i due organelli cellulari si fondono insieme, portando all'incontro di CB[7] e AdA. Gli scienziati possono rilevare la fusione, perché quando i due coloranti fluorescenti si avvicinano, interagiscono tra loro tramite il meccanismo di trasferimento di energia per risonanza di fluorescenza (FRET). In questo modo, il team di ricerca può analizzare il processo di autofagia passo dopo passo. Credito:Istituto per le scienze di base
Un team di ricercatori del Center for Self-assembly and Complexity, all'interno dell'Istituto per le scienze di base (IBS) hanno osservato un normale processo fisiologico, chiamato "auto-mangiare", che le cellule usano per riciclare i loro componenti. Hanno sviluppato una tecnica accurata che visualizza come i mitocondri, fabbriche di energia delle cellule, sono fusi con i lisosomi, macchine per il riciclaggio delle cellule, al fine di ottenere materiale distrutto e riciclato. Poiché le irregolarità in questo meccanismo possono portare all'Alzheimer, Parkinson, e altre complicazioni, questa ricerca potrebbe aiutare i futuri progressi nella diagnosi delle malattie degenerative del cervello e nello sviluppo di farmaci. Lo studio è stato pubblicato su Angewandte Chemie Edizione Internazionale .
Il nome "autofagia" deriva dalla lingua greca e significa "automangia". Per quanto strano possa sembrare, è un processo indispensabile utilizzato per pulire le cellule dagli organelli e dalle proteine danneggiati. All'interno dei lisosomi, le vecchie parti cellulari sono scomposte nei loro mattoni, che vengono impiegati per costruirne di nuovi. Recentemente, L'autofagia è diventata un campo di studio molto attivo ed è stata al centro del Premio Nobel per la Fisiologia o la Medicina di Yoshinori Ohsumi nel 2016.
Un esempio di organello cellulare che deve essere periodicamente riciclato è il mitocondrio. L'attenta regolamentazione di questo processo è essenziale, e cellule che non si dividono regolarmente, come le cellule nervose, sono particolarmente vulnerabili. Se le cellule accumulano mitocondri difettosi, possono danneggiarsi. Ciò si verifica, Per esempio, nelle malattie di Alzheimer e Parkinson, dove l'accumulo di mitocondri danneggiati e proteine aggregate porta alla morte neuronale.
È noto che l'autofagia (o mitofagia, nel caso specifico dei mitocondri) avviene per fusione di due diversi organelli, in questo caso:mitocondri e lisosomi. Però, osservare il comportamento e la fusione dei mitocondri e dei lisosomi all'interno delle cellule è stato impegnativo. Ad oggi, la maggior parte di questi studi si basa su proteine fluorescenti attaccate a un organello, che consente agli scienziati di osservare un solo organello alla volta. Inoltre, le stesse proteine fluorescenti vengono degradate durante l'autofagia, rendendo difficile lo studio accurato del meccanismo.
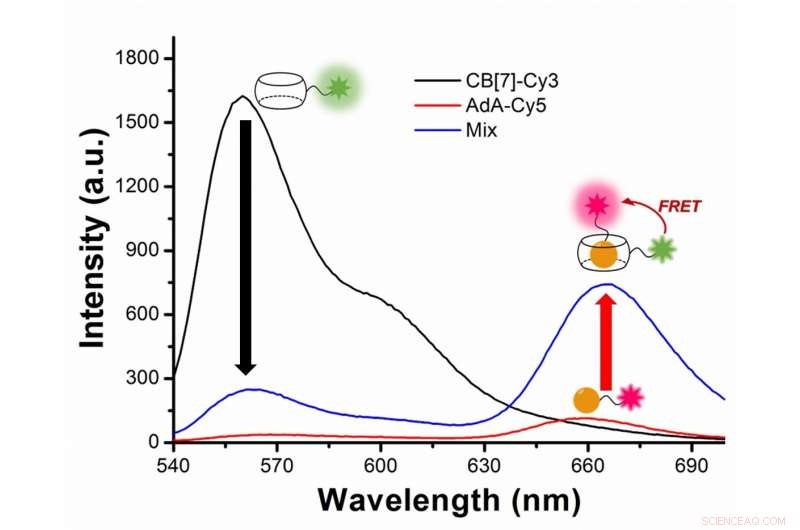
Figura 2:Studio dell'autofagia con trasferimento di energia di risonanza di fluorescenza (FRET) tra il colorante fluorescente verdastro Cy3 e il colorante fluorescente rosso Cy5. Cy3 emette fluorescenza con una lunghezza d'onda di picco a 563 nanometri (linea nera), mentre Cy5 a 670 nanometri (linea rossa). Nell'esperimento, Cy3 è collegato a CB[7] e Cy5 a AdA. Durante l'autofagia, i due coloranti si avvicinano e Cy3 trasferisce un po' di energia al suo colorante partner vicino Cy5, in seguito al fenomeno FRET. Gli scienziati catturano l'incontro dei due coloranti come un aumento della fluorescenza con lunghezza d'onda 644-800 nanometri (linea blu). Credito:Istituto per le scienze di base
Gli scienziati dell'IBS di POSTECH hanno ideato una procedura quantitativa per visualizzare sia i mitocondri che i lisosomi nel tempo. La tecnica relativamente semplice ed economica è più accurata di quelle attuali. Utilizza molecole sintetiche cave a forma di botte, noto come cucurbituril (CB[7]), che si lega con una forza di legame eccezionalmente elevata a una molecola chiamata adamantilammina (AdA) e non può essere degradata dai lisosomi. CB[7] è stato decorato con un colorante fluorescente (Cy3), mentre AdA con un altro colorante (Cy5). Inizialmente, CB[7]-Cy3 entra nei lisosomi e Ada-Cy5 nei mitocondri, poi, quando i due organelli si fondono nel processo di riciclaggio, CB[7]-Cy3 e Ada-Cy5 si legano insieme. In questo modo, il team di ricerca ha seguito il comportamento di diversi organelli e ha osservato il processo mitofagico che si verifica nelle cellule vive. Inoltre, gli esperimenti hanno mostrato che i due composti non sono tossici per le cellule al di sotto di una dose di 800 nanomolari.
"La parte più impegnativa dell'esperimento è stata la scelta delle sostanze chimiche. Abbiamo scelto sostanze chimiche con la giusta idrofilia, carica, e dimensione molecolare da incorporare selettivamente nei mitocondri e nei lisosomi, " spiega PARK Kyeng Min, uno dei corrispondenti autori dello studio.
In termini più tecnici, la novità di questo lavoro si basa sull'applicazione del trasferimento di energia per risonanza di fluorescenza (FRET) allo studio dell'autofagia. FRET è un trasferimento di energia dipendente dalla distanza tra due diversi coloranti fluorescenti; in questo caso Cy3 e Cy5. Quando i due sono abbastanza vicini, Cy3 dona energia a Cy5. Gli scienziati catturano l'incontro dei due coloranti poiché il trasferimento di energia da Cy3 a Cy5 porta a una riduzione dell'intensità della fluorescenza Cy3 a favore di un aumento dell'intensità dell'emissione di Cy5.
Nel futuro, una tecnica simile potrebbe essere utilizzata per studiare i processi di autofagia che coinvolgono altri organelli cellulari, come le fabbriche di proteine dell'apparato del Golgi e del reticolo endoplasmatico.