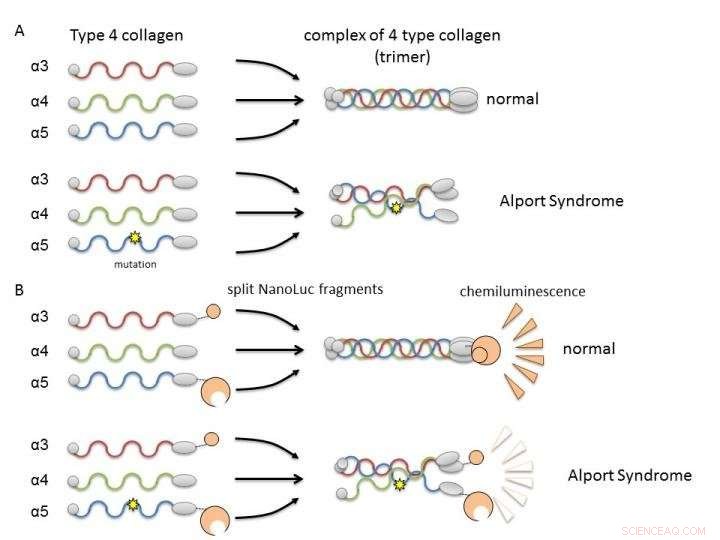
(A) Collagene IV alfa-3, alfa-4, e alfa-5 normalmente formano complessi (trimeri) e diventano costituenti della membrana basale nel rene. Nella sindrome di Alport, mutazione genetica in una delle catene interrompe la formazione del trimero. (B) Fondendo catene di collagene a frammenti di nanoluciferasi, è possibile valutare la formazione di trimeri di alfa-3, alfa-4, e alfa-5 per intensità di luminescenza. Credito:Dr. Kohei Omachi
La sindrome di Alport (AS) è una malattia renale ereditaria causata da una mutazione genetica che porta ad anomalie del collagene di tipo IV (Col4). Sfortunatamente, il trattamento attraverso la correzione della funzionalità Col4 non è stato ancora sviluppato. Ora, i ricercatori dell'Università di Kumamoto in Giappone hanno creato una tecnologia altamente sensibile per valutare la funzionalità di Col4, aprendo la strada ai farmaci terapeutici. Questo sistema di rilevamento riduce i costi di manodopera e di tempo rispetto ai metodi convenzionali, e monitora la funzionalità di Col4 con una sensibilità mai vista prima. Il sistema consente inoltre di analizzare contemporaneamente diversi composti candidati al farmaco.
È stato scoperto che gli ACE-inibitori e altri farmaci per il trattamento dell'ipertensione rallentano la progressione dell'AS. Però, questo trattamento allevia solo i sintomi e non può prevenire il passaggio all'insufficienza renale allo stadio terminale. Si ritiene quindi che il trattamento fondamentale debba concentrarsi sulla causa dell'insorgenza della malattia, un approccio completamente diverso dai metodi precedenti. La strategia terapeutica, in questo caso, si concentrerebbe sulla normalizzazione della funzione della proteina causale con un composto farmacologico candidato. In caso di successo, questa tecnica contribuirebbe notevolmente al trattamento di altre malattie ereditarie.
Per normalizzare la funzione della proteina responsabile con un composto farmacologico candidato, è necessario vagliare e identificare in modo efficiente i composti che ripristinano la funzione compromessa dalla mutazione genetica. Però, non è stato ancora sviluppato un sistema di analisi per valutare la funzionalità delle proteine causative. Un tale sistema potrebbe essere utilizzato per lo screening dei candidati a farmaci terapeutici. Così, I ricercatori dell'Università di Kumamoto miravano a stabilire un nuovo sistema di valutazione (un sistema di screening dei composti) proprio per questo scopo.
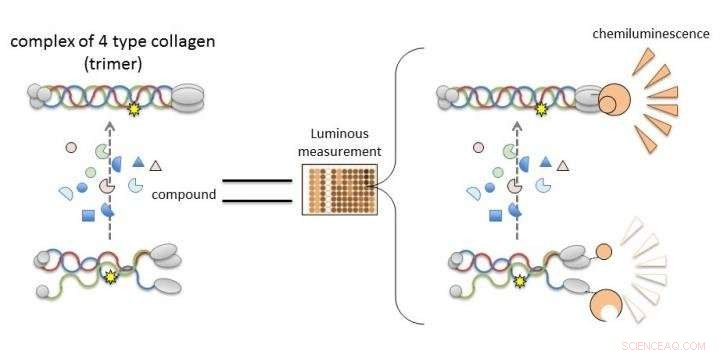
Collagene IV alfa-3, alfa-4, e alpha-5 nella sindrome di Alport non possono formare trimeri, quindi la scoperta di composti che portano o migliorano la loro formazione porterà allo sviluppo di nuove terapie. Un nuovo lavoro dell'Università di Kumamoto consente di valutare la trimerizzazione delle catene alfa del collagene IV misurando la luminescenza. È probabile che i composti che inducono luminescenza nel sistema NanoLuc-Col4 promuovono la trimerizzazione. Credito:Dr. Kohei Omachi
In Col4, tre catene polipeptidiche (proteine a bastoncino), alfa-3, alfa-4, e alfa-5, formano un complesso chiamato trimero proteico. Questo trimero è un fattore costitutivo della membrana basale nella parte del rene chiamata glomerulo. La membrana basale glomerulare è una barriera fisica contro la fuoriuscita di componenti del sangue durante la filtrazione del sangue, un'importante funzione renale per la produzione di urina. Una mutazione in una qualsiasi delle tre catene polipeptidiche può interrompere la formazione dei trimeri e provocare lo sviluppo di AS a causa dell'incapacità di formare correttamente la membrana basale. Perciò, è necessario ricercare composti che possano correggere o assistere la formazione di trimeri da parte del collagene mutante.
I ricercatori hanno utilizzato la NanoLuciferasi divisa (NanoLuc divisa, NanoBiT) per l'analisi dell'interazione proteina-proteina come metodo per valutare la formazione di trimeri. Frammenti di due grandi e piccole molecole di luciferasi sono stati fusi con catene alfa-3 e alfa-5 ed espressi in cellule con catene alfa-4. La luminescenza misurabile è stata rilevata solo quando alfa-3, alfa-4, e le catene alfa-5 potrebbero formare trimeri.
I ricercatori hanno chiarito che il sistema NanoLuc-Col4 riflette le caratteristiche precedentemente riportate di Col4, vale a dire che i trimeri si formano con una combinazione fissa di alfa-3, alfa-4, e catene alfa-5, e che le catene alfa-5 non possono formare trimeri se mancano una parte funzionale. Il sistema NanoLuc-Col4 ha anche rivelato che le catene alfa-5 con le mutazioni genetiche riportate in AS non funzionavano. È importante sottolineare che come prova di principio che è possibile correggere la formazione di trimeri per il collagene mutante, gli autori sono stati in grado di utilizzare il sistema per identificare composti in grado di indurre la formazione di trimeri di alfa-3, collagene alfa-4 e alfa-5 mutante.
"Questa ricerca dovrebbe fornire un percorso per sviluppare farmaci per malattie ereditarie, come la sindrome di Alport, che sono attualmente incurabili, ", ha affermato il professor Hirofumi Kai del Dipartimento di Medicina Molecolare dell'Università di Kumamoto.
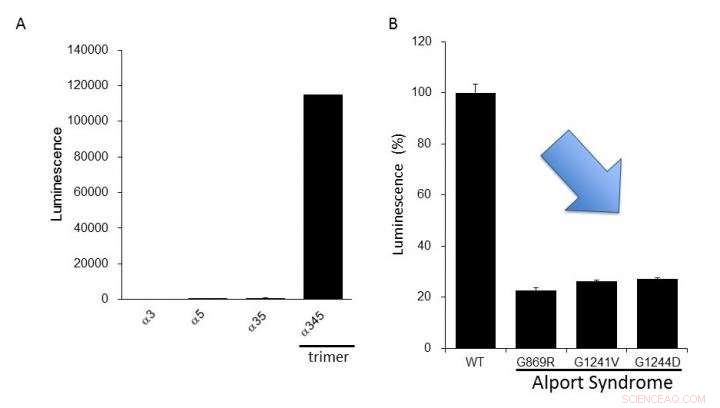
(A) Espressione del collagene IV alfa-3, alfa-4, e alfa-5 nelle cellule. L'elevata luminescenza è stata prodotta solo nella formazione del trimero alfa-345. (B) Le proteine alfa-5 mutanti riportate nella sindrome di Alport avevano una formazione di trimeri inferiore a quella del tipo normale (WT). Ciò suggerisce che possiamo valutare le anomalie funzionali del collagene IV riscontrate nella sindrome di Alport utilizzando questo sistema di analisi. Credito:Dr. Kohei Omachi