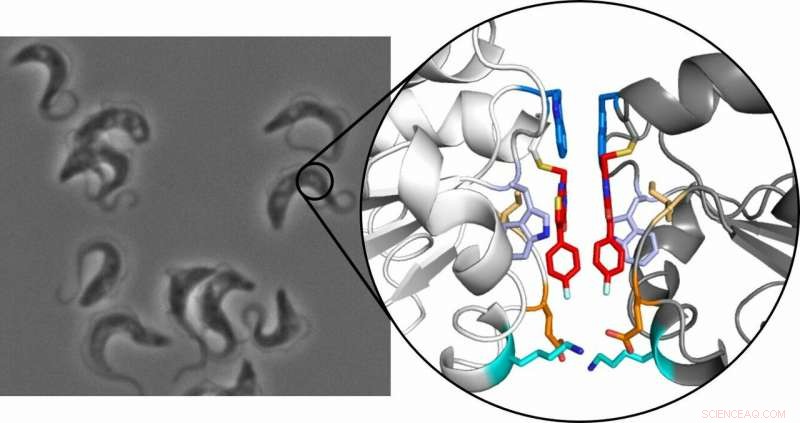
tripanosomi, che causano la malattia del sonno africana, al microscopio (a sinistra) e la struttura cristallina del dimero della tripedossina (a destra):le due molecole di inibitore sono evidenziate in rosso. Credito:Ute Hellmich, Annika Wagner
Scienziati che lavorano in una serie di discipline hanno unito le forze per identificare un nuovo approccio per combattere la malattia del sonno africana. La ricerca fondamentale condotta sotto la supervisione della professoressa Ute Hellmich dell'Università Johannes Gutenberg di Mainz (JGU) ha rivelato una strategia promettente per sviluppare un agente adatto. "C'è ancora molta strada da fare prima di arrivare a un prodotto farmaceutico, " ha detto Hellmich. "Ma il nostro lavoro altamente interdisciplinare che coinvolge la parassitologia, chimica teorica e organica, biologia strutturale, e la biochimica ha mostrato come il parassita che causa la malattia del sonno può essere reso innocuo." I ricercatori sono riusciti a dimostrare come una specifica sostanza inibitoria si aggancia e disattiva una proteina vitale del parassita.
La malattia del sonno africana è causata dai tripanosomi, protozoi unicellulari trasmessi dal morso di una mosca tse-tse infetta. Secondo l'Organizzazione Mondiale della Sanità, il numero di persone infette è diminuito negli ultimi anni, fino a circa 15, 000 nel 2014. Tuttavia, stabilire l'effettiva incidenza della malattia è difficile, poiché i primi sintomi sono simili a quelli della malaria. "Non solo le persone più povere dell'Africa subsahariana sono minacciate, ma anche il loro bestiame, che sono colpiti in modo drammatico da alcune specie di Trypanosoma brucei, " ha spiegato la professoressa biochimica Ute Hellmich.
Attualmente, solo una manciata di farmaci per curare la malattia del sonno, che è fatale se non trattata, sono disponibili e questi trattamenti sono spesso accompagnati da gravi effetti collaterali e persino decessi fino al 10% dei pazienti. Sebbene siano attualmente in fase di sviluppo nuovi farmaci, l'approccio del gruppo di Hellmich va oltre:"Il nostro inibitore apre la prospettiva futura di poter progettare inibitori a livello fondamentale e potrebbe quindi eventualmente essere utilizzato anche nel trattamento dell'infezione con altri, parassiti patogeni correlati, come Leishmania, " ha detto Annika Wagner, autore principale dello studio recentemente pubblicato in Angewandte Chemie Edizione Internazionale .
L'inibitore induce la dimerizzazione della proteina essenziale del parassita
Il principio si basa sul fatto che un piccolo, l'inibitore selettivo si lega all'enzima triparedossina. Questa proteina è essenziale per il parassita, proteggendolo dal danno ossidativo, ma non è presente nell'uomo, rendendolo un possibile bersaglio farmacologico. Con loro sorpresa, il team di ricercatori ha scoperto che quando l'inibitore si lega alla proteina, due dei risultanti complessi inibitore-proteina si combinano quindi per formare un dimero stabile. Quando ciò si verifica, la proteina solitamente monomerica cessa di funzionare.
"Siamo rimasti sbalorditi e inizialmente abbiamo pensato che fosse un effetto casuale dovuto alle condizioni sperimentali, " ha detto Hellmich. L'indagine è stata poi estesa, ed è stato verificato in uno studio su larga scala utilizzando vari metodi che l'effetto di dimerizzazione poteva essere riprodotto. Oltre ai gruppi di ricerca di Mainz del professor Ute Hellmich e del professor Till Opatz, ricercatori delle università di Francoforte, Würzburg, Heidelberg, e il Laboratorio europeo di biologia molecolare (EMBL) di Grenoble sono stati coinvolti.
La ricerca altamente interdisciplinare si dimostra vincente
La dimerizzazione che la ricerca ha scoperto è insolita perché la molecola responsabile è estremamente piccola. La maggior parte delle molecole che agiscono come un adesivo molecolare per combinare singoli monomeri per formare un dimero sono relativamente grandi. "La nostra molecola è molto più piccola e in grado di riconoscere direttamente la proteina, " ha spiegato Hellmich. Le piccole molecole sono anche più facili da contrabbandare nelle cellule, che potrebbe essere il punto di partenza per nuovi concetti di droga.
Dimostrando con precisione il meccanismo mediante il quale la proteina parassita viene chimicamente inibita e dimerizzata dalla piccola molecola, il partenariato di ricerca interdisciplinare ha messo in luce i fondamenti alla base di un concetto così nuovo. "Era fondamentale che non ci fermassimo al nostro obiettivo originale di determinare semplicemente la struttura cristallina del complesso proteina-inibitore, " disse Hellmich. "Invece, abbiamo dato una seconda occhiata al risultato e poi ne abbiamo discusso con esperti di diversi campi. La ricerca progredisce solo quando lavoriamo insieme".