L'ormone che favorisce il sonno melatonina (mostrato come una costellazione nel cielo notturno) è sintetizzato dalla serotonina (mostrato come un aquilone) durante la notte, ed entrambe queste molecole arcaiche sono anteriori all'evoluzione animale. Elevati livelli di melatonina durante la notte gli permettono di stabilire le sue proprietà di favorire il sonno agendo attraverso recettori ad alta affinità, raffigurato nella parte destra della composizione dell'immagine. Credito:Ekaterina Kadyshevskaya, Bridge Institute presso l'USC Michelson Center for Convergent Bioscience.
Un team internazionale di ricercatori ha utilizzato un laser a raggi X presso lo SLAC National Accelerator Laboratory del Dipartimento dell'Energia per creare le prime mappe dettagliate di due recettori della melatonina che dicono ai nostri corpi quando andare a dormire o svegliarsi e guidano altri processi biologici. Una migliore comprensione del loro funzionamento potrebbe consentire ai ricercatori di progettare farmaci migliori per combattere i disturbi del sonno, cancro e diabete di tipo 2. I loro risultati sono stati pubblicati in due articoli oggi in Natura .
Il gruppo, guidato dalla University of Southern California, ha usato i raggi X dalla Linac Coherent Light Source (LCLS) di SLAC per mappare i recettori, MT1 e MT2, legato a quattro diversi composti che attivano i recettori:un farmaco per l'insonnia, un farmaco che mescola la melatonina con l'antidepressivo serotonina, e due analoghi della melatonina.
Hanno scoperto che entrambi i recettori della melatonina contengono canali stretti incorporati nelle membrane grasse delle cellule del nostro corpo. Questi canali consentono solo alla melatonina, che può esistere sia nell'acqua che nel grasso, di passare, bloccando la serotonina, che ha una struttura simile ma è felice solo in ambienti acquosi. Hanno anche scoperto come alcuni composti molto più grandi possano colpire solo MT1 e non MT2, nonostante le somiglianze strutturali tra i due recettori. Questo dovrebbe informare la progettazione di farmaci che mirano selettivamente a MT1, che finora è stato impegnativo.
"Questi recettori svolgono funzioni immensamente importanti nel corpo umano e sono i principali bersagli farmacologici di grande interesse per l'industria farmaceutica, "ha detto Linda Johansson, uno studioso post-dottorato presso la USC che ha guidato il lavoro strutturale su MT2. "Attraverso questo lavoro siamo stati in grado di ottenere una comprensione molto dettagliata di come la melatonina è in grado di legarsi a questi recettori".
È ora di andare a letto
La gente lo fa, lo fanno gli uccelli, i pesci lo fanno. Quasi tutti gli esseri viventi del regno animale dormono, e per una buona ragione.
"È fondamentale che il cervello si riposi ed elabori e conservi i ricordi che abbiamo accumulato durante il giorno, " ha detto il co-autore Alex Batyuk, uno scienziato allo SLAC. "La melatonina è l'ormone che regola i nostri cicli sonno-veglia. Quando c'è luce, la produzione di melatonina è inibita, ma quando arriva l'oscurità questo è il segnale per il nostro cervello di andare a dormire."
I recettori della melatonina appartengono a un gruppo di recettori di membrana chiamati recettori accoppiati a proteine G (GPCR) che regolano quasi tutti i processi fisiologici e sensoriali nel corpo umano. MT1 e MT2 si trovano in molti punti del corpo, compreso il cervello, retina, sistema cardiovascolare, fegato, rene, milza e intestino..
Questi recettori sovrintendono ai nostri geni orologio, i cronometristi dell'orologio interno del corpo, o ritmo circadiano. In un mondo perfetto, i nostri orologi interni si sincronizzerebbero con il sorgere e il tramonto del sole. Ma quando le persone viaggiano attraverso fusi orari, lavorare di notte o passare troppo tempo davanti a schermi o altre fonti artificiali di luce blu, questi cronometristi sono sbalorditi.
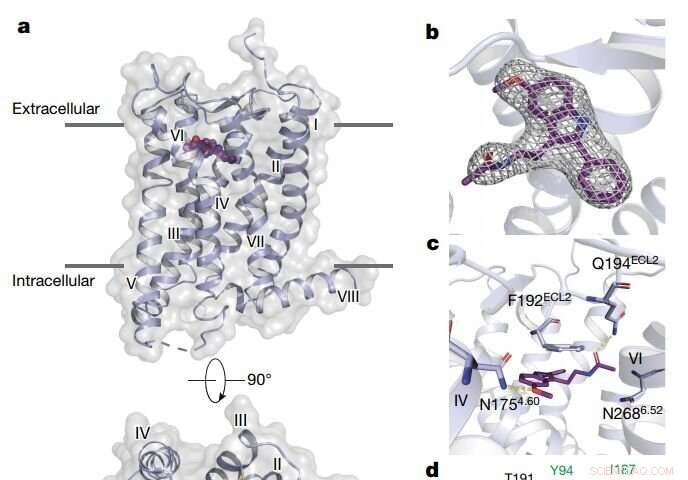
Panoramica della struttura MT2. Credito: Natura (2019). DOI:10.1038/s41586-019-1144-0
Controllare il ritmo
Quando i nostri ritmi circadiani sono interrotti, può portare a psichiatria, metabolico, oncologiche e molte altre condizioni. MT1 in particolare svolge un ruolo importante nel controllo di questi ritmi, ma la progettazione di farmaci che possono mirare selettivamente a questo recettore si è rivelata difficile. Molte persone prendono integratori di melatonina da banco per combattere i problemi del sonno o cambiare i loro ritmi circadiani, ma gli effetti di questi farmaci spesso svaniscono in poche ore.
Descrivendo i progetti di questi recettori e mappando il modo in cui i ligandi si legano e li attivano, i ricercatori hanno aperto la strada ad altri per progettare farmaci più sicuri, più efficace e in grado di colpire selettivamente ciascun recettore.
"Dalla scoperta della melatonina 60 anni fa, ci sono state molte scoperte storiche che hanno portato a questo momento, " disse Margherita L. Dubocovich, un illustre professore della SUNY di farmacologia e tossicologia presso l'Università di Buffalo che ha aperto la strada all'identificazione dei recettori funzionali della melatonina nei primi anni '80 e ha fornito una prospettiva esterna su questa ricerca. "Nonostante i notevoli progressi, la scoperta di farmaci MT1 selettivi è rimasta inafferrabile per il mio team e i ricercatori di tutto il mondo. La delucidazione delle strutture cristalline per i recettori MT1 e MT2 apre un nuovo entusiasmante capitolo per lo sviluppo di farmaci per il trattamento dei disturbi del sonno o del ritmo circadiano noti per causare disturbi psichiatrici, metabolico, condizioni oncologiche e molte altre".
Raccolta di cristalli
Per mappare le biomolecole come le proteine, i ricercatori usano spesso un metodo chiamato cristallografia a raggi X, disperdendo i raggi X dalle versioni cristallizzate di queste proteine e utilizzando i modelli che questo crea per ottenere una struttura tridimensionale. Fino ad ora, la sfida con la mappatura MT1, MT2 e recettori simili era quanto fosse difficile far crescere cristalli abbastanza grandi da ottenere strutture ad alta risoluzione.
"Con questi recettori della melatonina, abbiamo davvero dovuto fare il possibile, "ha detto Benjamin Stauch, che ha guidato i lavori strutturali su MT1. "Molte persone avevano cercato di cristallizzarli senza successo, quindi abbiamo dovuto essere un po' fantasiosi."
Un pezzo chiave di questa ricerca è stato il metodo unico utilizzato dai ricercatori per far crescere i loro cristalli e per raccogliere i dati di diffrazione dei raggi X da essi. Per questa ricerca, il team ha espresso questi recettori nelle cellule degli insetti e li ha estratti utilizzando un detergente. Hanno mutato questi recettori per stabilizzarli, consentendo la cristallizzazione. Dopo aver purificato i recettori, li hanno messi in un gel simile a una membrana, che supporta la crescita dei cristalli direttamente dall'ambiente della membrana. Dopo aver ottenuto i microcristalli sospesi in questo gel, hanno usato uno speciale iniettore per creare uno stretto flusso di cristalli che hanno eliminato con i raggi X da LCLS.
"A causa delle minuscole dimensioni dei cristalli, questo lavoro poteva essere svolto solo presso LCLS, " disse Vadim Cherezov, un professore USC che ha supervisionato entrambi gli studi. "Cristalli così piccoli non diffrangono bene alle sorgenti di sincrotrone poiché subiscono rapidamente danni da radiazioni. I laser a raggi X possono superare il problema del danno da radiazioni attraverso il principio della 'diffrazione prima della distruzione'".
I ricercatori hanno raccolto centinaia di migliaia di immagini dei raggi X sparsi per capire la struttura tridimensionale di questi recettori. Hanno anche testato gli effetti di dozzine di mutazioni per approfondire la loro comprensione di come funzionano i recettori.
Oltre a scoprire piccoli, gatekeeping canali della melatonina nei recettori, i ricercatori sono stati in grado di mappare le mutazioni associate al diabete di tipo 2 sul recettore MT2, vedere per la prima volta la posizione esatta di queste mutazioni nel recettore.
Gettare le basi
In questi esperimenti, i ricercatori hanno esaminato solo i composti che attivano i recettori, conosciuti come agonisti. Seguire, sperano di mappare i recettori legati agli antagonisti, che bloccano i recettori. Sperano anche di usare le loro tecniche per studiare altri recettori GPCR nel corpo.
"Come biologo strutturale, è stato emozionante vedere per la prima volta la struttura di questi recettori e analizzarli per capire come questi recettori riconoscono selettivamente le loro molecole di segnalazione, " Ha detto Cherezov. "Abbiamo saputo di loro per decenni, ma fino ad ora nessuno poteva dire come sono effettivamente guardare. Ora possiamo analizzarli per capire come riconoscono molecole specifiche, che speriamo ponga le basi per una migliore, farmaci più efficaci».