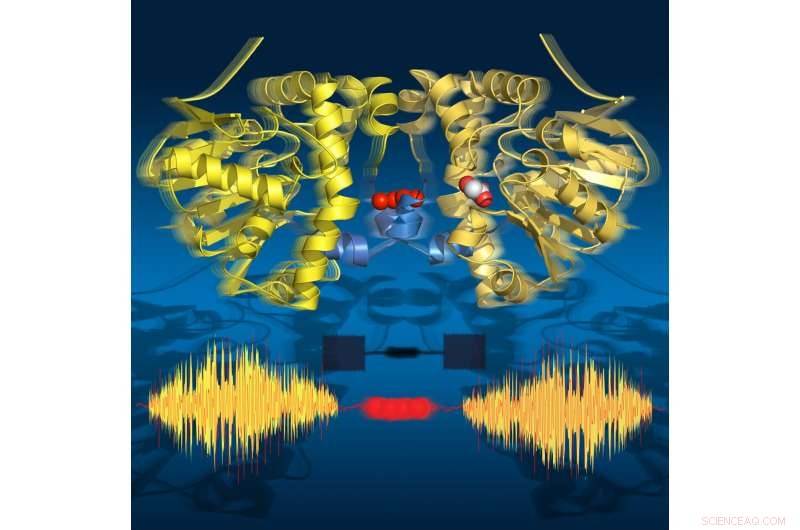
Le immagini time-lapse mostrano che l'enzima "respira" durante il turnover:si espande e si contrae in linea con le fasi secondarie catalitiche. Le sue due metà comunicano tramite una serie di molecole d'acqua. Credito:Joerg M. Harms, MPSD
Ricercatori del Dipartimento di Dinamica Risolta Atomicamente del Max Planck Institute for the Structure and Dynamics of Matter (MPSD) presso il Center for Free-Electron Laser Science di Amburgo, l'Università di Potsdam (entrambe in Germania) e l'Università di Toronto (Canada) hanno messo insieme un dettagliato filmato time-lapse che rivela tutti i passaggi principali durante il ciclo catalitico di un enzima. Sorprendentemente, la comunicazione tra le unità proteiche avviene tramite una rete idrica simile a un telefono di stringa. Questa comunicazione è allineata con un movimento di "respirazione", cioè l'espansione e la contrazione della proteina. Questa sequenza di strutture time-lapse rivela i movimenti dinamici come un elemento fondamentale nei fondamenti molecolari della biologia.
Tutta la vita è dinamica e lo sono anche i suoi mattoni molecolari. I moti ei cambiamenti strutturali delle biomolecole sono fondamentali per le loro funzioni. Però, comprendere questi movimenti dinamici a livello molecolare è una sfida formidabile. Come fa una proteina ad accelerare una reazione chimica, che ci vorrebbero anni per procedere senza aiuto?
A tal fine i ricercatori si sono rivolti a un enzima che scinde il legame singolo più forte della chimica organica:il legame C-F. I carboni fluorurati possono essere trovati in materiali come Teflon o GoreTex e in molti prodotti farmaceutici e pesticidi. I composti fluorurati hanno una particolare influenza sui cambiamenti climatici, superamento dell'efficacia della CO 2 per ordine di grandezza. Perciò, la capacità di comprendere meglio ed eventualmente controllare il turnover dei legami C-F è di particolare interesse per il cambiamento climatico e il biorisanamento.
I ricercatori hanno utilizzato la cristallografia a raggi X risolta nel tempo per scattare istantanee molecolari durante la reazione di turnover di questo enzima naturale a temperature fisiologiche. Questo filmato accelerato ha rivelato diciotto punti temporali da 30 millisecondi a 30 secondi, coprendo tutti i principali stati catalitici che portano alla rottura del legame C-F. Sorprendentemente, il film mostra anche che l'enzima "respira" durante il turnover, cioè si espande e si contrae allineato con i passaggi secondari catalitici.
Sorprendentemente, le due metà dell'enzima comunicano tra loro tramite una stringa di molecole d'acqua che collega entrambe le metà. Questa rete idrica consente alle due metà di "parlare" tra loro e condividere informazioni sul loro stato catalitico. Questo è fondamentale per la funzione dell'enzima poiché solo una metà dell'enzima può essere attiva in un dato momento.
Questi cambiamenti dinamici si sono rivelati cruciali per la funzione dell'enzima. I ricercatori si aspettano che molti altri sistemi sfruttino meccanismi simili per le loro attività.