Credito:Università di Cambridge
I ricercatori qui hanno escogitato una strategia per rendere enantioselettiva una reazione chimica catalizzata da metalli di transizione attraverso l'uso di un catione chirale. Il lavoro è stato svolto nel gruppo di ricerca del Dr. Robert Phipps.
In precedenza, Roberto dice, mentre i cationi chirali sono stati ampiamente utilizzati come organocatalizzatori, portarli in reazioni chimiche catalizzate da metalli di transizione per controllare l'enantioselettività della reazione è stato molto più raro. Ora, dopo due anni di duro lavoro "e tanto lavoro di squadra, "Ci sono riusciti.
Il loro lavoro, pubblicato in Scienza , è "essenzialmente una prova del concetto che puoi farlo, e che può essere fatto su un tipo di reazione impegnativo che si è dimostrato difficile con gli approcci esistenti, " lui dice.
Il gruppo Phipps sviluppa metodologie per la sintesi di piccole molecole, come i farmaci. Negli ultimi anni, hanno dedicato uno sforzo significativo allo sviluppo di catalizzatori in grado di controllare la selettività posizionale nelle reazioni chimiche, ad es. controllando esattamente in quale punto della molecola avviene la reazione chimica. Lo hanno fatto sviluppando ligandi per catalizzatori di metalli di transizione che ancorano il catalizzatore in una posizione particolare sulla molecola.
E hanno cercato modi per perfezionare ulteriormente i ligandi, in modo che siano in grado di renderli non solo posizionali selettivi ma anche enantioselettivi. Gli enantiomeri sono immagini speculari, come una mano sinistra e una mano destra, di una molecola. Potendo selezionare quale dei due enantiomeri della molecola essi producono, e quindi che tipo di 'mano' ha, è fondamentale.
Infatti, mentre un enantiomero della molecola può produrre l'effetto terapeutico desiderato, l'altro enantiomero può non produrre alcun effetto, o può portare effetti collaterali indesiderati. Inoltre, la chiralità, o 'mano, " dell'enantiomero può essere vitale per garantire la precisione nel modo in cui interagisce all'interno di un sistema biologico.
"La natura stessa mostra la chiralità in molti modi. Le proteine sono formate da blocchi di aminoacidi che esistono naturalmente come un enantiomero, cioè sono con una sola mano. Inoltre il DNA possiede una chiralità elicoidale, "Spiega Robert. "Così come chimici sintetici, è molto importante che siamo in grado di produrre piccole molecole come singoli enantiomeri. Quando metteremo una piccola molecola in un sistema biologico dove speriamo che lo faccia, Per esempio, un effetto terapeutico, l'enantiomero 'di sinistra' potrebbe adattarsi in modo molto diverso rispetto all'enantiomero 'di destra'."
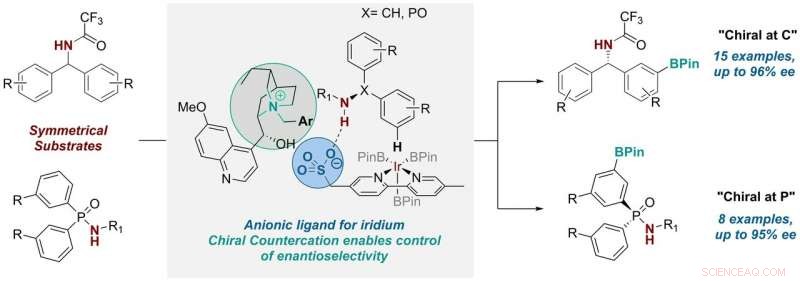
Tre anni fa, il gruppo ha sviluppato un ligando per catalizzatori di metalli di transizione che controllava la selettività posizionale in una reazione di attivazione C-H, una reazione utile ampiamente utilizzata nell'industria farmaceutica e solitamente ottenuta utilizzando la catalisi dei metalli di transizione. Lo hanno fatto prendendo un comune scaffold con legante bipiridinico e attaccandovi un gruppo anionico solfonato.
Avendo attaccato questo gruppo anionico (o caricato negativamente) all'impalcatura, avevano quindi bisogno di un componente caricato positivamente per bilanciarlo. Nel loro lavoro precedente, i ricercatori hanno utilizzato un catione comune (tetrabutilammonio) per questo ruolo, che inizialmente era solo per fornire la solubilità del sale in solventi organici. Ma si sono resi conto che "abbiamo avuto l'opportunità di portare qui un catione chirale che potrebbe essere potenzialmente coinvolto nello stato di transizione della reazione ed esercitare una certa influenza su di esso, " Spiega Robert. Così hanno deciso di esplorare se ciò fosse possibile.
dottorato di ricerca lo studente Georgi Genov ha lavorato per primo all'idea, che alla fine ha comportato altri due dottorati di ricerca. studenti, James Douthwaite e David Gibson, e un ricercatore post-dottorato, Antti Lahdenperä. Hanno sostituito il catione achirale tetrabutilammonio con un catione chirale derivato dal chinino antimalarico naturale. E così facendo, hanno scoperto di essere in grado di controllare non solo la selettività posizionale ma anche l'enantioselettività nella reazione, che sostituisce il legame C-H su un anello aromatico con un legame C-B versatile.
Georgi afferma:"Il processo di ottimizzazione per questa trasformazione è stato piuttosto complesso. Tuttavia, dopo aver scoperto il catione giusto e le condizioni di reazione, abbiamo osservato che il sistema era notevolmente generale, consentendoci di utilizzare due classi di substrato molto diverse:una in cui il nuovo stereocentro si trova su un atomo di carbonio, e uno dove è al fosforo. Quest'ultimo è molto eccitante in quanto la sintesi di composti chirali e fosforo è più impegnativa".
Finora, ci sono stati modi molto ben consolidati di fare reazioni enantioselettive con metalli di transizione, ma normalmente si basano sull'introduzione di un qualche tipo di chiralità direttamente nello scaffold del ligando attaccato al metallo e "ci possono essere degli svantaggi in questo approccio, il che significa che non funzionerà in alcune situazioni, "dice Roberto.
"Sappiamo che questi cationi chirali, del tipo che stiamo utilizzando, sono davvero privilegiati perché sono stati utilizzati in altri tipi di catalisi asimmetrica. Ma non sono stati quasi mai usati con i metalli di transizione. Quindi, se potessimo potenzialmente unire questi cationi chirali privilegiati con metalli di transizione reattivi, allora forse abbiamo un modo nuovo e abbastanza diverso di pensare alla catalisi asimmetrica dei metalli di transizione".
Aggiunge:"Siamo entusiasti di guardare a implementare questo su altre reazioni catalizzate da metalli di transizione davvero utili in cui esistono sfide nell'eseguirle in modo enantioselettivo. In particolare, vorremmo vedere se possiamo attivare reazioni enantioselettive che non sono state possibili prima, utilizzando questa strategia".