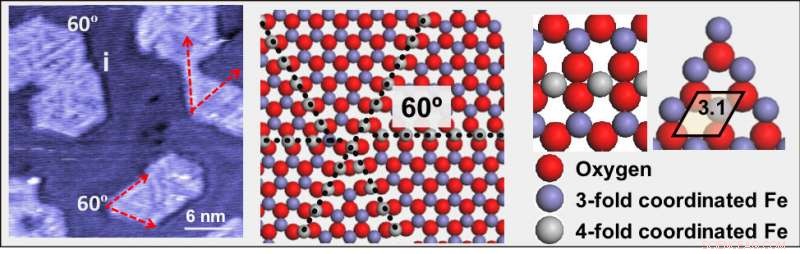
(Sinistra) Un'immagine al microscopio a effetto tunnel a scansione a pressione ambiente di ossido di ferro (FeO) su una superficie d'oro. (Al centro) Un'illustrazione che mostra le linee di dislocazione fatte di atomi di ferro (grigio), circondato da quattro atomi di ossigeno (rosso). (A destra) Un modello ingrandito che mostra gli atomi di ferro coordinati da tre (viola) e quattro (grigi) atomi di ossigeno (rosso). Credito:Brookhaven National Laboratory
catalizzatori, o sostanze che accelerano le reazioni chimiche, hanno diverse applicazioni industriali. Un catalizzatore ampiamente utilizzato nei convertitori catalitici è il palladio, che aiuta a trasformare il monossido di carbonio tossico e gli idrocarburi dallo scarico dei veicoli in anidride carbonica e acqua attraverso l'ossidazione. Ma come altri metalli preziosi come il platino, il palladio è raro. A causa della sua offerta limitata, il palladio è un bene costoso.
La sostituzione dei catalizzatori di metalli preziosi con quelli basati su metalli più abbondanti come il ferro ne ridurrebbe notevolmente il costo. Però, catalizzatori di ferro, pur essendo altamente efficiente, tendono a disattivarsi rapidamente. Per esempio, i catalizzatori a base di ossido di ferro si "avvelenano" quando le loro superfici sono ricoperte da specie di carbonio formatesi durante le reazioni con molecole contenenti carbonio, come quando il monossido di carbonio si dissocia in carbonio e ossigeno. Il carbonio depositato sulla superficie del catalizzatore blocca i siti attivi e impedisce che si verifichino ulteriori reazioni, quindi "avvelenamento" e infine disattivando il catalizzatore.
"Una forma di ossido di ferro, FeO, è un materiale molto economico che è attivo per l'ossidazione, ma troppo attivo per il suo bene, " disse Dario Stacchiola, leader dell'Interface Science and Catalysis Group presso il Center for Functional Nanomaterials (CFN), una struttura per gli utenti dell'Office of Science del Dipartimento dell'energia degli Stati Uniti (DOE) presso il Brookhaven National Laboratory, e professore a contratto presso il dipartimento di chimica della Stony Brook University. "La creazione di strutture con ferro sufficientemente attive da promuovere la reazione senza disattivarsi potrebbe aprire la porta all'utilizzo di questi catalizzatori in applicazioni pratiche".
Stacchiola e collaboratori hanno trovato una struttura che potrebbe essere in grado di fare proprio questo. Gli scienziati hanno preparato un sottile strato di nanoparticelle di FeO sopra una superficie d'oro e hanno scoperto che le linee di dislocazione che appaiono sulla superficie di FeO sono molto attive ma non vengono avvelenate. Queste linee di difetto sono costituite da atomi di ferro circondati da quattro atomi di ossigeno invece dei normali tre.
Il team ha rilevato i difetti nelle immagini ad alta risoluzione registrate tramite microscopia a effetto tunnel a scansione a bassa temperatura (STM) presso la CFN Proximal Probes Facility e la Nanjing University of Science and Technology in Cina, dove Tianchao Niu, membro del team ed ex postdoc CFN, è ora professore. In STM, la corrente elettrica viene misurata come tunnel di elettroni tra una superficie del campione e una punta metallica che esegue la scansione attraverso la superficie.
Gli scienziati hanno quindi studiato l'ossidazione e la riduzione di FeO in ambienti di gas ossigeno e monossido di carbonio, rispettivamente. Per monitorare la struttura atomica e chimica del catalizzatore, hanno eseguito studi di scienze della superficie a temperatura ambiente e pressione ambiente (AP). In particolare, hanno utilizzato uno strumento AP-STM all'avanguardia disponibile per gli utenti accademici e industriali presso il CFN.
"Volevamo vedere se il catalizzatore sarebbe stato attivo in condizioni moderate perché alte temperature o pressioni possono dissociare il monossido di carbonio in carbonio, disattivazione del catalizzatore, " ha detto Stacchiola. "Conducendo questi studi a pressione ambiente, possiamo osservare come il materiale cambia mentre è in funzione. Solo così potremo comprendere i processi chimici che avvengono a livello atomico e molecolare".
All'ossidazione, le linee di dislocazione sono scomparse e l'altezza dello strato di FeO è aumentata, suggerendo che gli atomi di ossigeno erano stati incorporati. Un'esposizione sequenziale al monossido di carbonio ha provocato la rigenerazione delle linee di dislocazione e una riduzione dell'altezza di FeO, indicando la rimozione degli atomi di ossigeno. Dopo aver eseguito l'imaging di ciascuna di queste fasi di reazione tramite AP-STM, gli scienziati hanno utilizzato la spettroscopia fotoelettronica a raggi X (XPS) per determinare quali specie chimiche erano presenti ei rispettivi stati di ossidazione (numero di elettroni rimossi o aggiunti). Queste informazioni chimiche possono essere determinate in base all'energia degli elettroni emessi dalla superficie del campione dopo l'eccitazione da parte dei raggi X.
"L'ossidazione e la riduzione di FeO sono reversibili, " ha detto Stacchiola. "L'ossigeno è stato aggiunto e rimosso senza lasciare il carbonio dietro. Poiché il ferro nelle linee di dislocazione è coordinato con un numero diverso di atomi di ossigeno rispetto al solito, il suo stato di ossidazione cambia. Questo cambiamento favorisce la dissociazione dell'ossigeno molecolare, una molecola molto stabile, in due atomi di ossigeno. L'accumulo di ossigeno atomico sulla superficie FeO a sua volta favorisce l'ossidazione del monossido di carbonio".
Zhao Jiang della Xi'an Jiaotong University in Cina ha poi calcolato l'energia del percorso di reazione. Jiang ha scoperto che l'ossidazione del monossido di carbonio è energeticamente più facile quando vengono adsorbiti atomi di ossigeno aggiuntivi sulla superficie di FeO.
Andando avanti, Stacchiola e il suo gruppo continueranno a esplorare i metalli abbondanti in terra per la catalisi. Ashley Head, uno scienziato del gruppo, in collaborazione con Baran Eren del Weizmann Institute of Science in Israele, ha recentemente studiato il ruolo che le impurità superficiali e l'ossido di manganese svolgono nel potenziamento catalitico dei catalizzatori al cobalto per la conversione del monossido di carbonio e dell'idrogeno in gas di sintesi, che viene utilizzato nella produzione di prodotti chimici e combustibili. Questo esperimento è stato uno dei primi interamente condotti con lo strumento AP-XPS presso la CFN Proximal Probes Facility.
"Le strutture complementari di microscopia e spettroscopia in situ aperte agli utenti CFN sono ideali per questo tipo di studi di chimica di superficie, " disse Stacchiola.