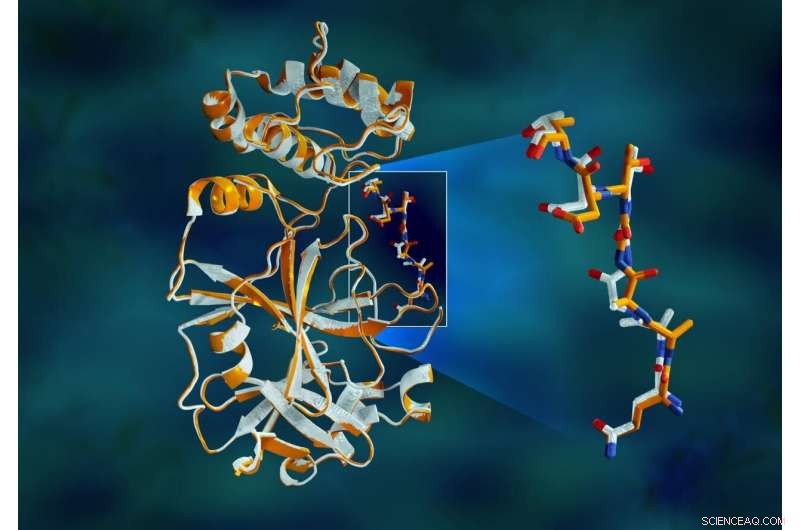
I dati a raggi X sovrapposti della proteasi principale SARS-CoV-2 mostrano differenze strutturali tra la proteina a temperatura ambiente (arancione) e la struttura criogenicamente congelata (bianca). Attestazione:Jill Hemman/ORNL, Dipartimento dell'Energia degli Stati Uniti
Un team di ricercatori dei laboratori nazionali Oak Ridge e Argonne del Dipartimento dell'Energia ha eseguito le prime misurazioni a raggi X a temperatura ambiente sulla proteasi principale SARS-CoV-2, l'enzima che consente al virus di riprodursi.
Le misurazioni a raggi X segnano un primo passo importante nell'obiettivo finale dei ricercatori di costruire un modello 3D completo della proteina enzimatica. Il modello sarà utilizzato per far avanzare simulazioni di supercalcolo volte a trovare inibitori di farmaci per bloccare il meccanismo di replicazione del virus e aiutare a porre fine alla pandemia di COVID-19. I risultati della loro ricerca sono pubblicamente disponibili e sono stati pubblicati sulla rivista Comunicazioni sulla natura .
SARS-CoV-2 è il virus che causa la malattia COVID-19. Il virus si riproduce esprimendo lunghe catene di proteine che devono essere tagliate in lunghezze minori dall'enzima proteasi.
"La proteasi è indispensabile per il ciclo di vita del virus. La proteina ha la forma di un cuore di San Valentino, ma è davvero il cuore del virus che gli permette di replicarsi e diffondersi. Se inibisci la proteasi e fermi il cuore, il virus non può produrre le proteine che sono essenziali per la sua replicazione. Ecco perché la proteasi è considerata un bersaglio farmacologico così importante, " ha detto Andrey Kovalevsky di ORNL, autore corrispondente. Mentre la struttura è nota da cristalli conservati criogenicamente, "Questa è la prima volta che la struttura di questo enzima è stata misurata a temperatura ambiente, il che è significativo perché è vicino alla temperatura fisiologica in cui operano le cellule".
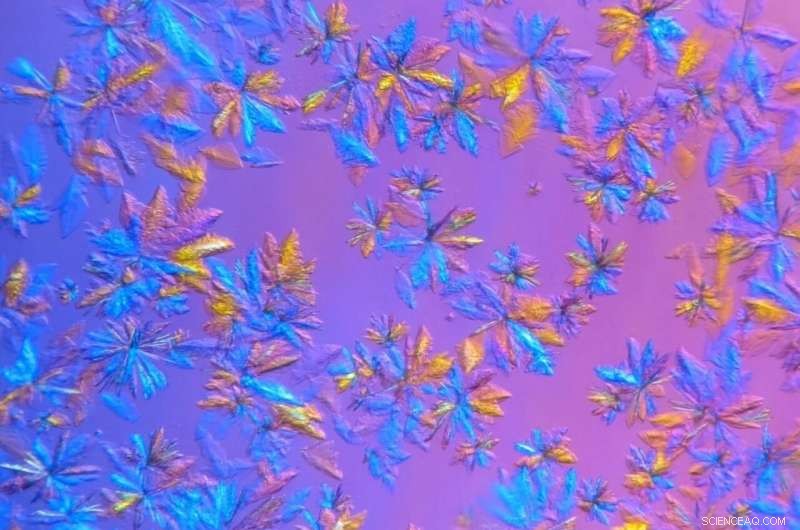
Cristalli di proteasi SARS-CoV-2, cresciuto nel laboratorio di cristallizzazione e caratterizzazione delle proteine dell'ORNL e raffigurato in vista microscopica, verranno utilizzati in esperimenti di diffusione di raggi X. Credito:Daniel Kneller/ORNL, Dipartimento dell'Energia degli Stati Uniti
La costruzione di un modello completo della struttura proteica richiede l'identificazione di ogni elemento all'interno della struttura e di come sono disposti. I raggi X sono ideali per rilevare elementi pesanti come carbonio, atomi di azoto e ossigeno. A causa dell'intensità dei fasci di raggi X nella maggior parte delle strutture di sincrotrone su larga scala, i campioni biologici in genere devono essere congelati criogenicamente a circa 100 K, o circa meno 280 gradi Fahrenheit, resistere alle radiazioni abbastanza a lungo da consentire la raccolta dei dati.
Per prolungare la durata dei campioni di proteine cristallizzate e misurarli a temperatura ambiente, I ricercatori dell'ORNL hanno coltivato cristalli più grandi di quanto richiesto per gli studi sui criotroni e hanno utilizzato una macchina a raggi X interna che presenta un raggio meno intenso.
"La crescita di cristalli proteici e la raccolta di dati è un processo noioso e dispendioso in termini di tempo. Nel tempo normalmente necessario per preparare e spedire il campione a un sincrotrone, siamo stati in grado di far crescere i cristalli, prendere le misure e iniziare ad analizzare i dati, " ha detto Daniel Kneller di ORNL, primo autore dello studio. "E, quando c'è una pandemia con molti scienziati che si mobilitano per studiare questo problema, non c'è un giorno da perdere."
L'enzima proteasi è costituito da catene di amminoacidi con uno schema ripetuto di atomi di azoto-carbonio-carbonio che formano la spina dorsale della proteina. Gruppi laterali dei mattoni degli amminoacidi, o "residui, " si estendono da ciascuno degli atomi di carbonio della spina dorsale centrale. L'enzima è piegato in una forma tridimensionale specifica, creando tasche speciali dove si attacca una molecola di farmaco.
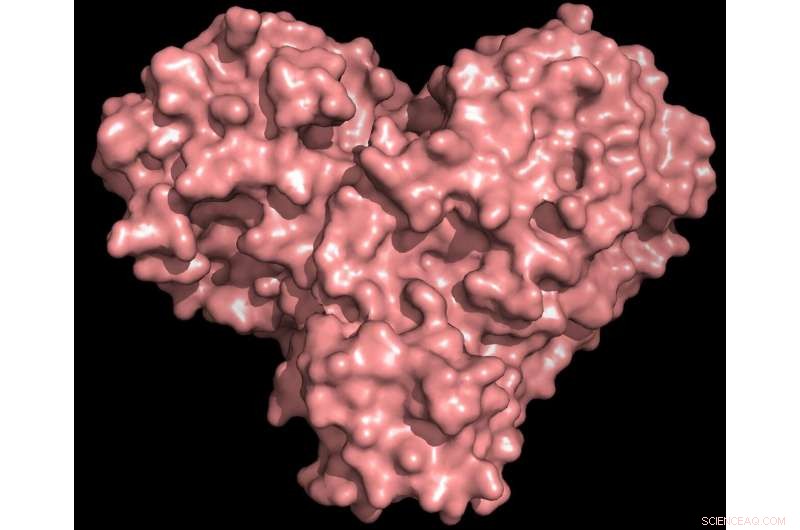
La proteina proteasi ha la forma di un cuore e funziona come uno, permettendo al virus di replicarsi e diffondersi. L'inibizione della proteasi bloccherebbe la riproduzione del virus. Credito:Credito:Andrey Kovalevsky/ORNL, Dipartimento dell'Energia degli Stati Uniti
Lo studio ha rivelato significative disparità strutturali tra gli orientamenti della spina dorsale e alcuni dei residui nei campioni a temperatura ambiente e criogenici. La ricerca suggerisce che il congelamento dei cristalli può introdurre artefatti strutturali che potrebbero risultare in una comprensione meno accurata della struttura della proteasi.
I risultati del team vengono condivisi con i ricercatori, guidato dal presidente del governatore dell'ORNL-Università del Tennessee Jeremy Smith, che stanno conducendo simulazioni di attracco di farmaci utilizzando Summit all'ORNL, il supercomputer più veloce della nazione.
"Ciò che i ricercatori stanno facendo su Summit è prendere composti noti di farmaci e cercare di legarli computazionalmente alla proteasi principale per il riutilizzo dei farmaci, oltre a cercare nuovi contatti in altri potenziali candidati a farmaci, " ha detto l'autore corrispondente di ORNL Leighton Coates. "I nostri dati sulla temperatura ambiente vengono utilizzati per costruire un modello più accurato per tali simulazioni e migliorare le attività di progettazione dei farmaci".
Il prossimo passo dei ricercatori nel completare il modello 3D della proteasi principale SARS-CoV-2 è utilizzare la diffusione di neutroni presso il reattore di isotopi ad alto flusso di ORNL e la sorgente di neutroni di spallation. I neutroni sono essenziali per localizzare gli atomi di idrogeno, che svolgono un ruolo critico in molte delle funzioni catalitiche e negli sforzi di progettazione di farmaci.
Il DNA plasmidico della proteasi utilizzato per produrre l'enzima è stato fornito dal Centro di biologia strutturale di Argonne presso l'Advanced Photon Source. La cristallizzazione delle proteine utilizzate negli esperimenti di diffusione dei raggi X è stata eseguita presso il Centro di biologia strutturale e molecolare dell'ORNL.