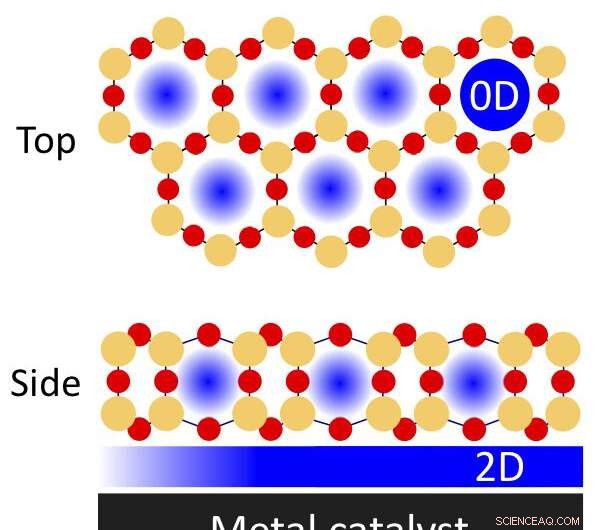
Un'illustrazione di spazi fisicamente confinati in un film di silice a doppio strato poroso su un catalizzatore metallico che può essere utilizzato per reazioni chimiche. Gli atomi di silicio sono indicati dai cerchi arancioni; atomi di ossigeno dai cerchi rossi. Il nanoconfinamento può avvenire nei pori (zero-dimensionale, o 0-D) e la regione confinata all'interfaccia tra il film e il metallo (bidimensionale, 2-D). Credito:Brookhaven National Laboratory
Gli spazi fisicamente confinati possono favorire reazioni chimiche più efficienti, secondo recenti studi condotti da scienziati del Brookhaven National Laboratory del Dipartimento dell'Energia degli Stati Uniti (DOE). Hanno scoperto che ricoprendo parzialmente le superfici metalliche fungendo da catalizzatori, o materiali che accelerano le reazioni, con film sottili di silice può influenzare le energie e le velocità di queste reazioni. La sottile silice forma una matrice bidimensionale (2-D) di "gabbie" a forma di prisma esagonale contenenti atomi di silicio e ossigeno.
"Queste strutture di silice porosa hanno lo spessore di soli tre atomi, " ha spiegato Samuel Tenney, un chimico nell'Interface Science and Catalysis Group del Center for Functional Nanomaterials (CFN) del Brookhaven Lab. "Se i pori fossero troppo alti, alcuni rami di molecole non sarebbero in grado di raggiungere l'interfaccia. C'è una particolare geometria in cui le molecole possono entrare e legarsi, un po' come il modo in cui un enzima e un substrato si uniscono. Molecole con le dimensioni appropriate possono scivolare attraverso i pori e interagire con la superficie metallica cataliticamente attiva".
"La silice a doppio strato non è effettivamente ancorata alla superficie metallica, " ha aggiunto Calley Eads, un ricercatore nello stesso gruppo. "Ci sono forze deboli in mezzo. Questa debole interazione consente alle molecole non solo di penetrare nei pori ma anche di esplorare la superficie catalitica e trovare i siti più reattivi e la geometria di reazione ottimizzata muovendosi orizzontalmente nello spazio confinato tra il doppio strato e il metallo. Se fosse ancorato, il doppio strato avrebbe solo un sito di pori per ogni molecola per interagire con il metallo".
Gli scienziati stanno scoprendo che gli spazi confinati modificano diversi tipi di reazioni, e stanno lavorando per capire perché.
Tenney ed Eads sono autori co-corrispondenti su ricerche recentemente pubblicate in Angewandte Chemie , dimostrando questo effetto di confinamento per una reazione di importanza industriale:l'ossidazione del monossido di carbonio. Il monossido di carbonio è un componente tossico dello scarico dei motori dei veicoli e quindi deve essere rimosso. Con l'aiuto di un appropriato catalizzatore di metalli preziosi come il palladio, platino, o rodio, i convertitori catalitici nei veicoli combinano il monossido di carbonio con l'ossigeno per formare anidride carbonica.
Tenney, Ead, e colleghi del CFN e della National Synchrotron Light Source II (NSLS-II) di Brookhaven hanno dimostrato che la copertura del palladio con silice aumenta la quantità di anidride carbonica prodotta del 20 percento, rispetto alla reazione su palladio nudo.
Per ottenere questo miglioramento delle prestazioni, gli scienziati hanno prima dovuto ottenere una struttura a doppio strato completo sulla superficie del palladio. Fare così, hanno riscaldato una quantità calibrata di silicio a temperature di sublimazione in un ambiente di ossigeno ad alta pressione. Nella sublimazione, un solido si trasforma direttamente in un gas. Mentre veniva creato il sottile film di silice, hanno sondato la sua struttura con la diffrazione elettronica a bassa energia. In questa tecnica, gli elettroni che colpiscono un materiale diffrangono secondo uno schema caratteristico della struttura cristallina del materiale.
"Continuiamo a riscaldare finché non otteniamo strutture altamente cristalline con dimensioni dei pori ben definite che possiamo usare per esplorare la chimica che ci interessa, " disse Ead.
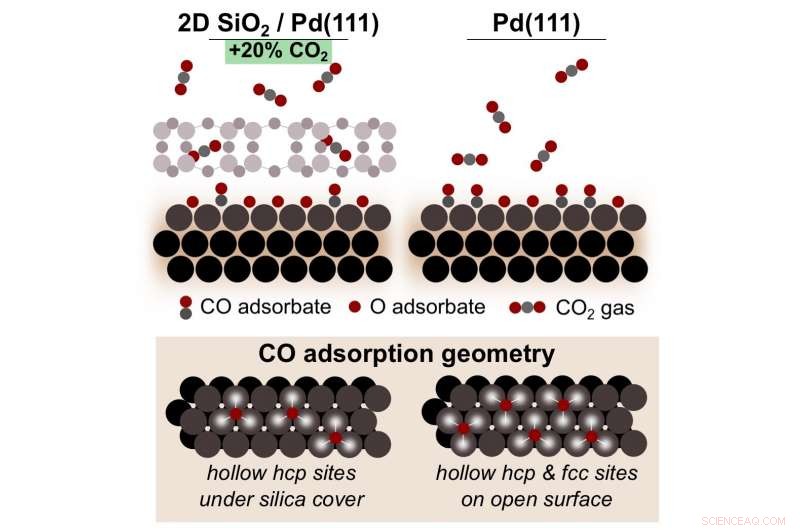
Uno schema che mostra come l'ossidazione del monossido di carbonio (CO) su palladio (Pd) sotto una silice microporosa 2-D (SiO, 2) la copertura produce il 20% in più di anidride carbonica (CO 2 ), rispetto alla reazione sul Pd nudo. Questo microambiente interfacciale favorisce una maggiore copertura di ossidi superficiali reattivi di Pd che sono fondamentali per convertire la CO in CO 2 . Credito:Brookhaven National Laboratory
Qui, il team ha monitorato i reagenti e i prodotti e l'ambiente di legame chimico nello spazio confinato 2-D durante l'ossidazione del monossido di carbonio, aumentando progressivamente la temperatura. Per tenere traccia di queste informazioni, hanno condotto simultaneamente la spettroscopia fotoelettronica a raggi X a pressione ambiente (AP-XPS) e la spettrometria di massa (MS) al NSLS-II e la spettroscopia ad assorbimento a riflessione infrarossa (IRAAS) al CFN.
"AP-XPS ci dice quali elementi sono presenti, siano essi in superficie o in fase gassosa, " ha detto Tenney. "Può anche darci informazioni sullo stato di ossidazione chimica o sulla geometria di legame degli atomi:se un carbonio è legato a uno o due atomi di ossigeno, Per esempio. La SM ci aiuta a identificare le molecole in fase gassosa che vediamo evolvere nel nostro sistema in base al loro peso e alla loro carica. IRRAS è un'impronta digitale del tipo di legami chimici presenti tra gli atomi e mostra la conformazione e l'orientamento delle molecole di monossido di carbonio adsorbite sulla superficie".
Secondo il coautore Dario Stacchiola, leader del CFN Interface Science and Catalysis Group, una delle capacità uniche del team è la capacità di utilizzare strumenti complementari di caratterizzazione della superficie per analizzare lo stesso campione senza esporlo all'aria, che potrebbe causare contaminazione.
"La riproducibilità è spesso un problema nella catalisi, " ha detto Stacchiola. "Ma abbiamo una configurazione che ci consente di preparare un campione in condizioni di ultra alto vuoto molto incontaminate ed esporre lo stesso campione a pressioni di gas industrialmente rilevanti".
I risultati sperimentali hanno mostrato un forte aumento della quantità di anidride carbonica al di sopra di una temperatura critica. Al di sotto di questa temperatura, il monossido di carbonio "avvelena" la superficie, impedendo che la reazione proceda. Però, una volta raggiunta la soglia di temperatura, l'ossigeno molecolare inizia a dividersi in due singoli atomi di ossigeno sulla superficie del palladio e forma un ossido superficiale. Questi atomi di ossigeno si combinano con il monossido di carbonio per formare anidride carbonica, prevenendo così l'avvelenamento.
"Lo spazio confinato sta cambiando l'energia e la cinetica della reazione per produrre più anidride carbonica, "disse Ead, che ha guidato la recente implementazione di questo nuovo approccio di analisi della superficie multimodale per lo studio di film nanoporosi in condizioni operative.
"Applicando film sottili su un catalizzatore tradizionale che è stato studiato per decenni, abbiamo introdotto una "manopola" per adattare la chimica a determinate reazioni, " ha detto Tenney. "Anche un miglioramento dell'uno per cento nell'efficienza del catalizzatore può tradursi in risparmi economici nella produzione su larga scala".
"Abbiamo scoperto che uno strato molto sottile di un ossido poco costoso può aumentare significativamente l'attività catalitica senza aumentare la quantità del costoso metallo prezioso utilizzato come catalizzatore, "aggiunse Stacchiola.

Crescita e caratterizzazione di un film di silice a doppio strato utilizzando un microscopio elettronico a bassa energia (LEEM) con imaging a pieno campo. Questo tipo di microscopia consente agli scienziati di seguire i cambiamenti nella struttura del film mentre cresce in tempo reale. La figura (a) mostra una superficie di palladio pulita ripresa con LEEM (sfera grande) e il relativo modello di diffrazione elettronica (sfera piccola). La figura (b) mostra i modelli di imaging e diffrazione per la silice a doppio strato (SiO2) cresciuta su palladio. Credito:Brookhaven National Laboratory
In precedenza, il team ha studiato le dinamiche della reazione dell'alcol furfurilico su una superficie di palladio ricoperta da silice a doppio strato. L'alcol furfurilico è una molecola derivata dalla biomassa che può essere convertita in biocarburante. Rispetto all'ossidazione del monossido di carbonio, che fa un solo prodotto, le reazioni con biomolecole più grandi e complesse come l'alcol furfurilico possono generare molti sottoprodotti indesiderati. I loro dati preliminari hanno mostrato il potenziale per regolare la selettività della reazione dell'alcol furfurilico con la copertura di silice a doppio strato.
"Il cambiamento dell'attività catalitica è fantastico, questo è ciò che vediamo nello studio sull'ossidazione del monossido di carbonio, " ha detto Stacchiola. "Il prossimo passo è dimostrare che possiamo usare le coperture di ossido per regolare la selettività per particolari reazioni. Riteniamo che il nostro approccio possa essere ampiamente applicato nella catalisi".
L'anno scorso, altri membri del gruppo di Stacchiola, insieme ai colleghi del CFN Theory and Computation Group, Stony Brook University (SBU), e l'Università del Wisconsin-Milwaukee, hanno pubblicato uno studio correlato in Catalisi ACS , una rivista dell'American Chemical Society (ACS). Combinando esperimento e teoria, hanno scoperto perché la reazione di formazione dell'acqua catalizzata dal metallo rutenio viene accelerata sotto confinamento con silice a doppio strato.
"La chimica negli spazi confinati è un'area di ricerca piuttosto nuova, " ha detto l'autore corrispondente Deyu Lu, un fisico nel CFN Theory and Computation Group. "Nell'ultima decade, ci sono state molte segnalazioni che il confinamento ha un impatto sulla chimica, ma una comprensione meccanicistica su scala atomica è stata in gran parte carente."
Nel Catalisi ACS studio, il team CFN ha dimostrato che il confinamento può cambiare il percorso attraverso il quale avviene la reazione. La formazione dell'acqua può procedere attraverso due possibili vie di reazione:idrogenazione diretta e sproporzione. La differenza principale è come viene prodotto il primo gruppo ossidrile, l'ossigeno legato all'idrogeno. Secondo i calcoli di Lu e del primo autore e studente della SBU Mengen Wang, questa fase di reazione costa più energia.
Nella via diretta, le molecole di idrogeno si dissociano sulla superficie in due atomi di idrogeno, che si combinano con un ossigeno chimicamente assorbito sulla superficie. Questi gruppi ossidrilici si combinano con un altro atomo di idrogeno per produrre acqua. Per il percorso di sproporzione, l'acqua, che può ancora provenire inizialmente dal percorso diretto, deve prima essere stabilizzata in superficie. Quindi, l'acqua può combinarsi con un ossigeno superficiale per formare due gruppi ossidrilici sulla superficie. Questi gruppi ossidrilici possono unirsi a due atomi di idrogeno per formare due molecole d'acqua. Queste molecole d'acqua possono quindi formare più gruppi idrossilici, formando un anello nel percorso di sproporzione.
Negli esperimenti AP-XPS in laboratorio presso il CFN, il team ha scoperto che la temperatura necessaria per attivare la reazione di formazione dell'acqua era molto più bassa quando la silice copriva il rutenio, rispetto al metallo stesso.
"Il fatto che la reazione avvenga a temperature più basse in confinamento è parzialmente correlato alla sua energia di attivazione inferiore, " ha spiegato l'autore corrispondente Anibal Boscoboinik, un chimico nel CFN Interface Science and Catalysis Group. "Dai dati AP-XPS sull'ossigeno di superficie, possiamo ricavare indirettamente l'energia necessaria per attivare la reazione. Vediamo che questa energia di attivazione è molto più bassa quando la silice è sopra il rutenio".
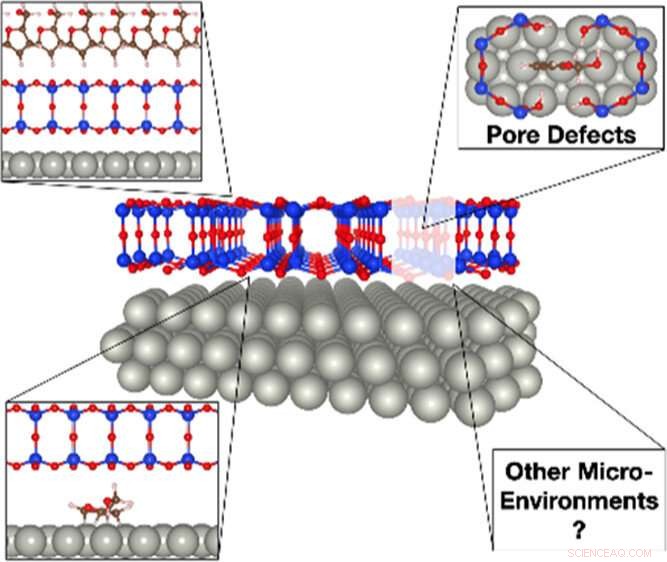
Un'illustrazione dell'impatto della silice a doppio strato sulla conversione della biomassa. Molecole di biomassa voluminose come l'alcol furfurilico possono infiltrarsi nel film di silice solo nei siti di difetto dei pori per interagire con il palladio cataliticamente attivo. Una volta intrappolato sotto la copertura di silice, l'alcol furfurilico può scomporre in diversi derivati, in particolare propano, che è difficile da produrre sulla superficie aperta. Credito:Brookhaven National Laboratory
Applicando un popolare metodo computazionale chiamato teoria del funzionale della densità, il team ha utilizzato i supercomputer per studiare l'energia della reazione. Inizialmente, gli sperimentali hanno ipotizzato che l'energia di attivazione ridotta per la fase di limitazione della velocità della reazione (creazione del primo gruppo ossidrile) fosse dovuta alla silice che preme sul complesso di reazione. Però, i calcoli hanno mostrato che la presenza di silice non ha modificato significativamente questa energia. Piuttosto, ha cambiato il percorso di reazione. Sulla nuda superficie di rutenio, è stata favorita la via diretta; in presenza di silice, molecole d'acqua stabilizzate sulla superficie, attivando la via della sproporzione.
"Senza la copertura di silice, le molecole d'acqua si desorbono, e la reazione segue il percorso diretto, " disse Lu. "Sotto la copertura di silice, l'acqua ha bisogno di attraversare diverse barriere di energia cinetica per lasciare la superficie. Queste barriere cinetiche intrappolano le molecole d'acqua sulla superficie del metallo e attivano il percorso di sproporzione, consentendo ai gruppi ossidrile di essere prodotti a una barriera energetica molto più bassa, rispetto al caso senza gli effetti del confinamento".
Sebbene la formazione dell'acqua non sia rilevante a livello industriale, gli scienziati affermano che studiare questo modello di reazione può aiutarli a capire come sfruttare gli effetti di confinamento per favorire determinati percorsi di reazione per reazioni più rilevanti. In altre parole, lo stesso principio fondamentale può essere applicato ad altri sistemi. Per esempio, la silice potrebbe essere rivestita su elettrodi per evocare percorsi particolari alle interfacce liquido-solido nelle celle elettrochimiche. In quel caso, la reazione sarebbe l'opposto:l'acqua si dissocia in ossigeno e idrogeno, un carburante pulito.
"Capire questa reazione ci aiuta a capire la reazione inversa, " disse Boscoboinik, che ha recentemente pubblicato una sintesi degli studi iniziali sugli effetti di confinamento con film sottili porosi 2-D. "Se fossimo guidati solo dall'esperimento, avremmo attribuito la spiegazione sbagliata. La teoria ha dimostrato che la nostra ipotesi iniziale non era corretta e ha svolto un ruolo chiave nel rivelare il corretto meccanismo di reazione a livello microscopico".
Ancora, gli scienziati hanno visto altri esempi in cui la silice ha un effetto correlato alla pressione. Nel 2019, hanno scoperto che la silice a doppio strato preme sul gas nobile xeno all'interfaccia tra la silice a doppio strato e il rutenio, inducendo un legame più forte tra xeno e rutenio.
"Diversi effetti derivano dalla reclusione, " ha detto Stacchiola. "E 'molto interessante, ricco, e zona per lo più inesplorata. Siamo entusiasti di continuare a indagare sulla chimica negli spazi ristretti nei prossimi anni".