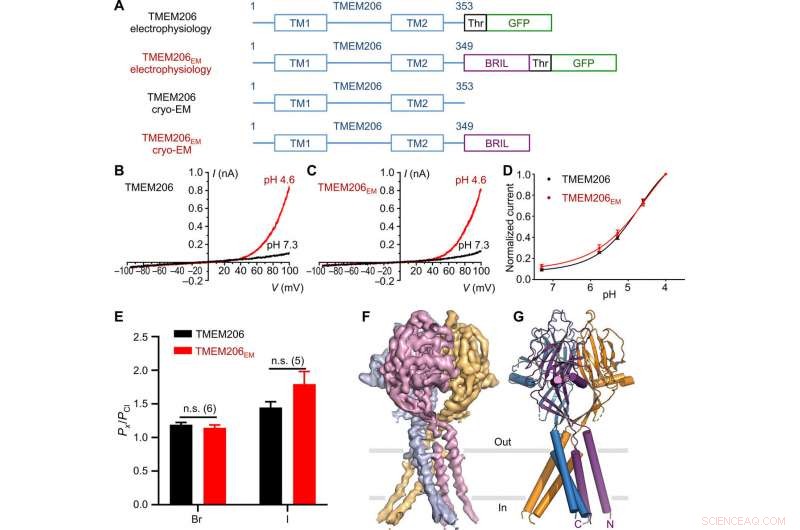
Funzione e struttura del pesce palla TMEM206. (A) Schema dei costrutti di canale utilizzati per l'elettrofisiologia e gli esperimenti di crio-EM a singola particella. "Thr" rappresenta un sito di scissione della trombina. (B e C) Tracce di corrente a cellule intere rappresentative attivate da pH extracellulare 4,6 per pesci palla TMEM206 (B) e TMEM206EM (C). I costrutti del canale sono stati espressi in cellule 293T di rene embrionale umano knockout TMEM206 (HEK). (D) Relazioni normalizzate tra corrente e pH del pesce palla TMEM206 (n =da 6 a 9 celle per punto dati) e TMEM206EM (n =da 5 a 6 celle per punto dati). Tutte le correnti sono state registrate a temperatura ambiente e normalizzate a correnti di pH 4.0 a +100 mV. (E) Selettività anionica per pesci palla TMEM206 e TMEM206EM. I dati sono presentati come medie ± SEM (n.s., insignificante; Test t di studente). (F) Densità Cryo-EM del pesce palla TMEM206EM sagomata a 7,0 e colorata da singole subunità. (G) Struttura trimerica del pesce palla TMEM206EM. Credito: Progressi scientifici , doi:10.1126/sciadv.abe5983
La proteina transmembrana 206 abbreviata in TMEM206 è un canale del cloro conservato evolutivamente che è alla base dell'ubiquità espressa, attivato da protoni, Correnti anioniche che raddrizzano verso l'esterno. In un nuovo rapporto ora pubblicato su Progressi scientifici , Zengqin Deng e un team di ricerca multidisciplinare presso la Washington University School of Medicine, a San Luigi, Gli Stati Uniti hanno descritto la struttura della microscopia crioelettronica (crio-EM) del pesce palla TMEM206. La struttura formava un canale trimerico con due segmenti transmembrana e un grande dominio extracellulare. Secondo i risultati, Deng et al. ha mostrato come un ampio vestibolo nella regione extracellulare fosse accessibile lateralmente da tre portali laterali, dove il poro centrale conteneva più costruzioni. Ad esempio, un residuo di lisina conservato vicino alla regione citoplasmatica dell'elica interna, presumibilmente formato il filtro di selettività ionico cloruro. La struttura e l'assemblaggio del nucleo assomigliavano a quelli dei canali del sodio che non sono correlati nella sequenza degli amminoacidi, e quindi condurre cationi invece di anioni. Insieme all'elettrofisiologia, hanno fornito approfondimenti sulla conduzione ionica e sul gate per una nuova classe di canali del cloro che sono architettonicamente distinti dalle famiglie di canali del cloro descritte in precedenza.
Canali ionici cloruro
Gli ioni cloruro sono anioni abbondanti negli animali, e si muovono attraverso le membrane cellulari tramite canali del cloro e trasportatori per una varietà di funzioni cellulari, compresa la regolazione del volume cellulare, acidificazione intracellulare e controllo dell'eccitabilità nei muscoli. Gli ioni sono ampiamente osservati nelle cellule dei mammiferi sebbene i componenti molecolari dietro le correnti di cloruro siano rimasti elusivi fino ad ora. Due studi indipendenti che hanno utilizzato lo screening dell'interferenza dell'RNA a livello di genoma avevano identificato TMEM206 come il canale anionico sottostante. Il TMEM206 è conservato evolutivamente nei vertebrati. I canali del cloro sono diversi sia nella sequenza degli amminoacidi che nell'architettura tridimensionale. In questo lavoro, Deng et al. ha presentato una struttura di microscopia crioelettronica (crio-EM) del pesce palla TMEM206 per rivelare un'architettura del canale trimerico diversa da quelle precedentemente note. Gli scienziati hanno combinato l'elettrofisiologia con questo lavoro per fornire la prima descrizione strutturale e funzionale di un canale del cloro conservato evolutivamente e ampiamente espresso per stabilire una struttura molecolare e comprendere la conduzione del cloro e il gating del canale.
Struttura della subunità e assemblaggio del canale. (A) Struttura di una singola subunità, che mostra il dominio transmembrana (rosso), dominio interno (blu), dominio β esterno (arancione), e HTH (verde). Sono indicati gli elementi secondari della struttura. (B) Assemblaggio del canale trimerico. Due delle subunità sono mostrate nella rappresentazione superficiale. (C) Vista ortogonale come in (B), dal lato extracellulare. Credito: Progressi scientifici , doi:10.1126/sciadv.abe5983 
I ricercatori hanno utilizzato costrutti marcati con proteine fluorescenti verdi per identificare i candidati TMEM206 e il pesce palla selezionato TMEM206 a causa della loro identità di sequenza condivisa al 50% con il canale del cloruro umano. Deng et al. quindi ha purificato la proteina TMEM206 del pesce palla wild-type a lunghezza intera e l'ha sottoposta ad analisi crio-EM a singola particella. Utilizzando mappe di ricostruzione 3D, hanno rivelato un'architettura del canale trimerico con domini transmembrana ed extramembrana. Il TMEM206 formava un trimero simmetrico, dove ogni subunità conteneva un dominio transmembrana (TMD) con due eliche che attraversano la membrana denominate TM1 e TM2 e un grande dominio extracellulare (ECD) arricchito con domini con motivi aggiuntivi ulteriormente organizzati negli strati superiore e inferiore. Inoltre, estesi contatti della catena laterale sono stati coinvolti attraverso interazioni di van der Waals nei domini β interno ed esterno. Il gruppo del canale trimerico ha introdotto tre aperture laterali o portali laterali nel mezzo della regione extracellulare per facilitare probabilmente il passaggio di ioni e acqua. I portali laterali allungati si estendono alla giunzione ECD-TMD per riprendere le interazioni di imballaggio strette. Per superare eventuali difficoltà tecniche di determinazione della struttura della proteina, Deng et al. ha fuso il C-terminale della proteina transmembrana indotta da interferone ristretta all'osso (abbreviato BRIL); una proteina del fascio a quattro eliche ampiamente utilizzata come chaperone di cristallizzazione per migliorare la stabilità della membrana e promuovere la formazione di cristalli.
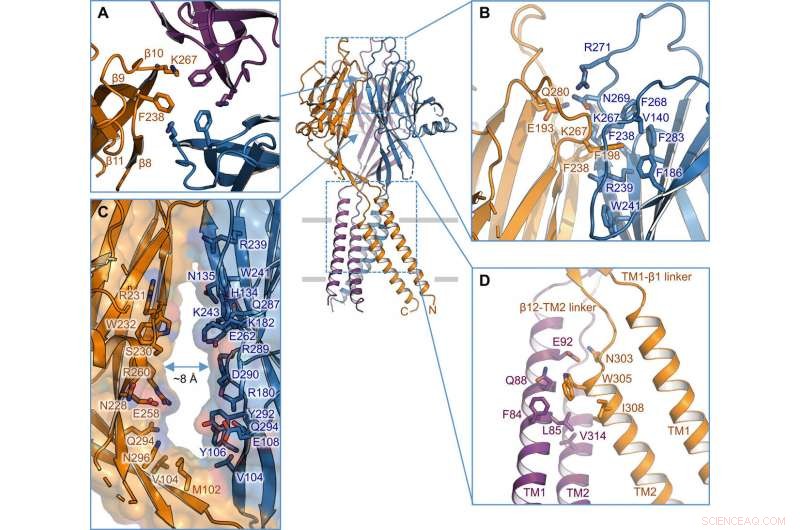
Interfaccia tra subunità. (A) Interfaccia trimerica all'apice dell'ECD. Sono evidenziate le catene laterali di K267 e F238. (B) Vista laterale dell'interfaccia intersubunità nello strato superiore dell'ECD. I residui coinvolti nell'interfaccia sono mostrati nella rappresentazione dello stick. (C) Portale laterale al centro dell'ECD tra due subunità vicine. Sono illustrate la superficie e i residui che rivestono la parete. (D) Interfaccia intersubunità TM1-TM2. Credito: Progressi scientifici , doi:10.1126/sciadv.abe5983
Via di permeazione ionica e studi di mutagenesi
Utilizzando i calcoli del raggio dei pori, Deng et al. ha mostrato come il poro centrale di conduzione degli ioni contenesse più costrizioni per impedire il passaggio degli ioni. La struttura rappresentava una conformazione non conduttiva a causa delle condizioni tampone a pH elevato (pH 8,0) utilizzate per determinare la struttura crio-EM. Il voluminoso e allungato vestibolo centrale poteva essere accessibile lateralmente a causa della mancanza di contatti proteina-proteina nel dominio extracellulare. Il punto stretto del canale proteico non interferiva con la conduzione ionica e poteva essere mantenuto durante il ciclo di gating del canale mentre gli ioni passavano attraverso i tre portali laterali. Il potenziale elettrostatico leggermente positivo delle pareti interne del vestibolo centrale e degli ingressi laterali facilitava anche l'attrazione degli ioni cloruro. Alla giunzione dominio extracellulare-dominio transmembrana (ECD-TMD), tre filamenti collegati alle eliche esterne e spostati verso l'interno per unirsi alle eliche interne per generare una porta extracellulare sopra lo strato bilipidico. Costruzioni consecutive nelle posizioni rivolte verso i pori formavano una porta idrofoba che poteva impedire la conduzione ionica.
Per supportare i risultati strutturali, Deng et al. hanno eseguito studi di mutagenesi su residui chiave della vita dei pori. Quando hanno sostituito i residui basici conservati con alanina o residui acidi, le correnti di cloruro attivate dall'acido furono abolite. In contrasto, le sostituzioni di arginina hanno mantenuto la funzione del canale per supportare ulteriormente il requisito di cariche positive nel filtro anione-selettivo. Ad esempio, il dominio I310 ha formato un componente critico della porta transmembrana e un'altra struttura nota come K320 ha formato il filtro di selettività anionica. Il lavoro ha supportato la conservazione strutturale tra gli ortologhi umani e pesci palla per rappresentare un modello fisiologicamente rilevante per i canali del cloro.
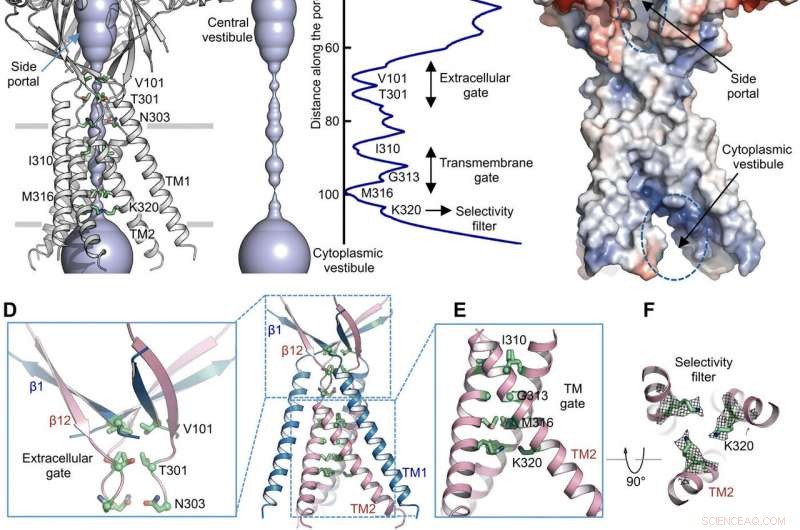
Via di permeazione ionica. (A) Struttura di TMEM206EM e il poro di conduzione ionica centrale, mostrato nella rappresentazione di superficie. I residui che generano costrizioni sono evidenziati ed etichettati. Il portale laterale è indicato. (B) Poro di conduzione ionica centrale e stima del raggio (pannello di destra). (C) Rappresentazione superficiale del canale, colorato dal potenziale elettrostatico superficiale (rosso, -5 kT/e; bianco, neutro; blu, +5 kT/e). Sono indicati il portale laterale e il vestibolo citoplasmatico. (D) Porta extracellulare alla giunzione ECD-TMD. V101, T301, e N303 sono mostrati nella rappresentazione dello stick. (E) Porta transmembrana, costituito da I310, G313, e M316. (F) Filtro di selettività putativo definito da K320. Sono mostrate anche le densità della catena laterale per K320, sagomato a 6.5 . (G e H) Densità di corrente con un pH extracellulare di 7,3 (G) e 4,6 (H) a +100 mV per i mutanti TMEM206. Le correnti della membrana dell'intera cellula sono state registrate utilizzando una rampa di tensione da -100 a +100 mV per 500 ms con un potenziale di mantenimento di 0 mV. (I) Rapporto di densità di corrente a pH 4,6 a pH 7,3. Credito: Progressi scientifici , doi:10.1126/sciadv.abe5983
Convergenza strutturale
La topologia, la struttura e l'assemblaggio di TMEM206 rappresentavano quelli della superfamiglia dei canali ionici del canale epiteliale del sodio (ENaC)/degenerina, compresi i canali ionici sensibili all'acido (ASIC); nonostante una mancanza di omologia di sequenza amminoacidica distinta tra i due canali. I canali trimerici per gli ioni sodio e cloruro di carica opposta, tuttavia condivideva una struttura centrale comune affiancata da due eliche transmembrana. Il team ha notato come il cancello extracellulare tra il vestibolo centrale e il poro transmembrana potesse essere espanso per far passare gli ioni dopo l'attivazione del canale. Mentre i canali epiteliali del sodio potrebbero essere attivati rilasciando peptidi inibitori attraverso la proteolisi nel dominio extracellulare, gli ASIC e TMEM206 potrebbero essere attivati solo da protoni extracellulari. Le caratteristiche strutturali conservate tra TMEM e AS1CS hanno suggerito anche analoghi cambiamenti conformazionali di gating per le due molecole.
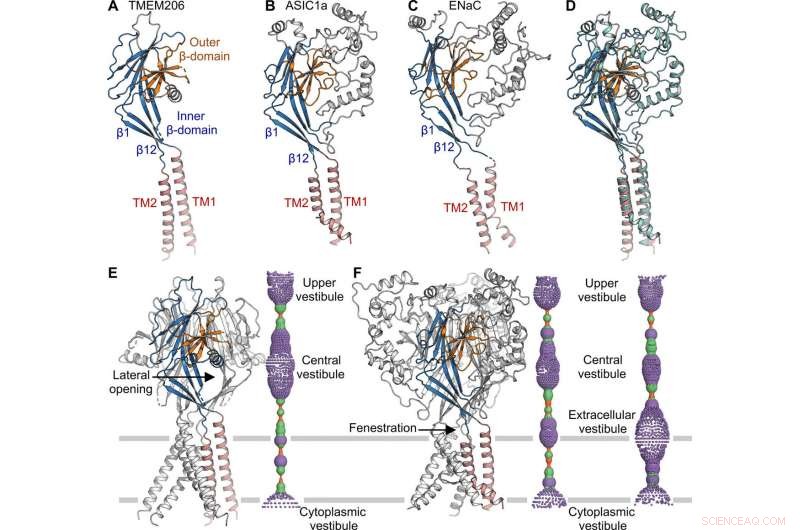
Confronto strutturale con ASIC ed ENaC. (da A a C) Strutture di subunità di TMEM206 (A), ASIC1a [Banca Dati Proteine (PDB):6AVE] (B), e ENaC (PDB:6BQN) (C). I domini sono di colore simile. (D) Sovrapposizione di TMEM206, colorato come in (A), e ASIC1a colorati in ciano. (E) Canale trimerico TMEM206 e il suo poro centrale di conduzione ionica. Il poro viene stimato utilizzando il programma HOLE e rappresentato come punti colorati (raggio dei pori:rosso <1,15
Veduta
In questo modo, Zengqin Deng e colleghi hanno utilizzato la crio-EM a singola particella per determinare la struttura delle proteine integrali di membrana che sono tipicamente irraggiungibili utilizzando la cristallografia a raggi X tradizionale. È ancora una sfida tecnica significativa ottenere una risoluzione quasi atomica per proteine di membrana di piccole dimensioni a causa del basso contrasto e del rapporto segnale-rumore. Deng et al. ottenuto una struttura di risoluzione di 3,5 angstrom di un canale fondendo un piccolo chaperone BRIL di cristallizzazione per migliorare la stabilità delle proteine di membrana altrimenti subottimali per promuovere l'impaccamento dei cristalli. Sulla base della struttura centrale conservata, i canali erano selettivi sia per cationi che per anioni e sperimentavano cambiamenti conformazionali di gating simili. Il lavoro ha stabilito una nuova classe di canali del cloro per formare una nuova struttura per ulteriori indagini funzionali e meccaniche nella biologia cellulare e strutturale.
© 2021 Science X Network