Un'illustrazione che mostra l'hotspot controllato da pinzette ottiche per la caratterizzazione strutturale delle proteine mediante spettroscopia Raman con superficie migliorata. Credito:Vince St. Dollente Mesias, Jinqing Huang / Università della scienza e della tecnologia di Hong Kong
È difficile analizzare le proteine a basse concentrazioni, specialmente per quelli in una miscela di varie conformazioni come le proteine intrinsecamente disordinate (IDP). Un gruppo di ricerca guidato dal Prof. Huang Jinqing, Assistant Professor del Dipartimento di Chimica presso la Hong Kong University of Science and Technology (HKUST), ha sviluppato la spettroscopia Raman accoppiata a pinzette ottiche in grado di sondare direttamente le caratteristiche strutturali dell'alfa-sinucleina, un IDP strettamente legato alla malattia di Parkinson, alla concentrazione fisiologica concentrandosi sulle singole molecole proteiche.
Gli sfollati interni svolgono un ruolo importante nei processi biologici e molti di loro sono associati a malattie neurodegenerative incurabili. Come un tipico IDP, alfa-sinucleina manca di un'architettura 3-D stabile nota come strutture secondarie. Subisce spontaneamente delle conversioni da una struttura secondaria ad un'altra, che potrebbe eventualmente provocare l'accumulo di aggregati proteici coinvolti nella patologia del morbo di Parkinson. Però, le specie transitorie durante la conversione possiedono varie strutture ed esistono in bassa popolazione in un miscuglio dinamico di equilibrio. Perciò, le loro caratteristiche strutturali sono solitamente sepolte sotto i risultati di rilevamento delle tecniche di misurazione tradizionali, che media i segnali rilevati da grandi quantità di campioni e lunghi tempi di rilevamento.
Nello studio, La prof.ssa Huang e i suoi collaboratori integrano pinzette ottiche e spettroscopia Raman con superficie migliorata (SERS) in una nuova piattaforma per generare miglioramenti SERS sintonizzabili e riproducibili con sensibilità a livello di singola molecola in ambienti acquosi, al fine di caratterizzare questi IDP mantenendo la loro intrinseca eterogeneità di grande significato biologico. Nello specifico, un hotspot può essere visualizzato e controllato da pinzette ottiche per consentire alle proteine di passare attraverso una camera a flusso microfluidico, il che rende conveniente regolare i parametri di misura in tempo reale per le caratterizzazioni spettroscopiche in situ. Identifica direttamente le caratteristiche strutturali delle specie transitorie di alfa-sinucleina tra i suoi monomeri predominanti alla concentrazione fisiologica di 1 μM riducendo la media dell'insieme in quantità e nel tempo, fornendo informazioni approfondite per comprendere l'inizio dell'aggregazione della proteina amiloide. Quindi, questa piattaforma SERS ha un grande potenziale per rivelare le informazioni strutturali degli sfollati interni nella dinamica, eterogeneo, e sistemi biologici complessi.
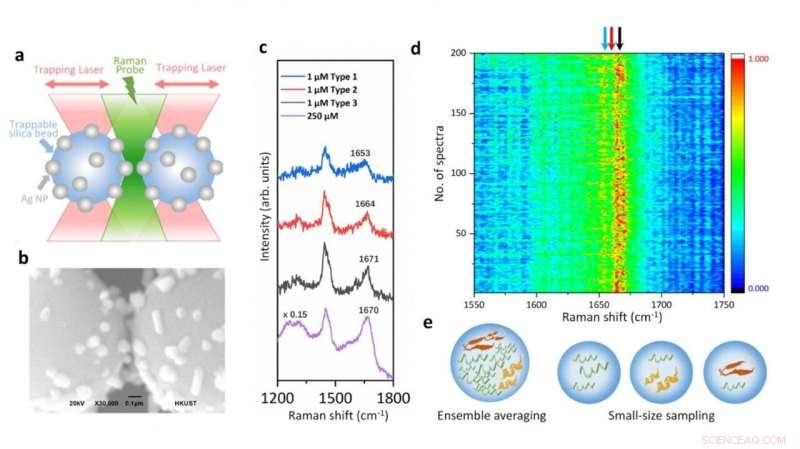
Illustrazione della piattaforma di spettroscopia Raman accoppiata a pinzette ottiche e degli spettri SERS di alfa-sinucleina a concentrazione fisiologica che mostrano le variazioni strutturali derivanti dalle sue specie transitorie. Credito:Vince St. Dollente Mesias, Jinqing Huang/Università della Scienza e della Tecnologia di Hong Kong
"La nostra strategia consente il controllo preciso dell'hotspot tra due perline di silice rivestite di nanoparticelle d'argento micrometriche intrappolate per migliorare l'efficienza e la riproducibilità del SERS nei rilevamenti acquosi. Fatta eccezione per il miglioramento del SERS sintonizzabile, le pinzette ottiche integrate offrono anche una risoluzione spaziale sub-nanometrica e una sensibilità alla forza sub-piconewton per monitorare le interazioni luce-materia nell'hotspot plasmonico per ulteriori informazioni fisiche. Ma ancora più importante, il nostro metodo apre una nuova porta per caratterizzare le specie transitorie di IDP in soluzioni diluite, che rimane una sfida significativa nella comunità biofisica. In definitiva, sarà emozionante sfruttare appieno la precisa manipolazione della forza delle pinzette ottiche integrate per dispiegare una singola proteina all'interno dell'hotspot controllabile e risolvere la sua dinamica strutturale dalle vibrazioni molecolari endogene mediante la spettroscopia Raman integrata, " ha detto il prof. Huang.
Lo studio è stato recentemente pubblicato sulla rivista scientifica Comunicazioni sulla natura .