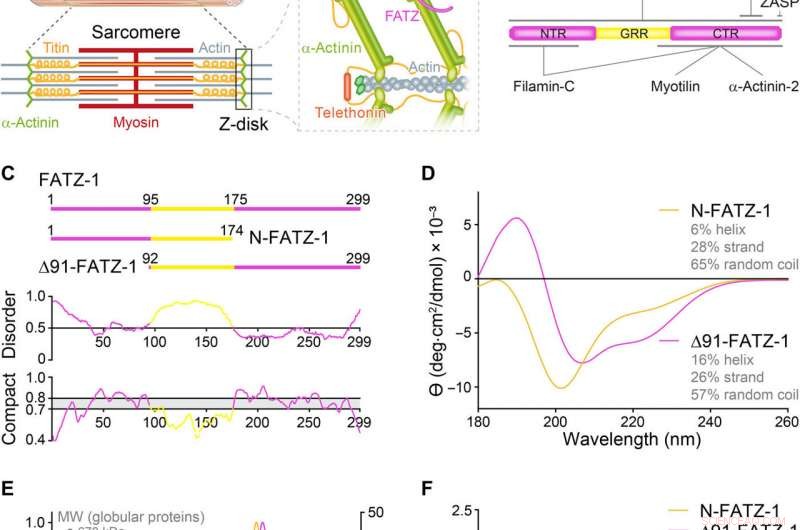
Le proteine della famiglia FATZ mostrano un disturbo intrinseco. (A) Schemi del sarcomero muscolare striato e vista ravvicinata delle interazioni F-actina/α-actinina/FATZ nel disco Z. (B) Schemi dell'interattoma FATZ-1 e dei siti di legame riportati fino ad oggi. (C) Schemi dei principali costrutti FATZ-1, insieme ai loro confini amminoacidici e alla composizione del dominio. Di seguito sono mostrate le regioni disordinate previste (sopra 0,5) e la compattezza (sopra 0,8). (D) Spettri di dicroismo circolare (CD) di N-FATZ-1 e Δ91-FATZ-1, insieme al contenuto calcolato della struttura secondaria. (E) Cromatografia ad esclusione dimensionale (SEC) – analisi multiangolo di diffusione della luce (MALS) di N-FATZ-1 e Δ91-FATZ-1, ottenendo pesi molecolari (MW) di 21 e 24 kDa, rispettivamente. I volumi di eluizione erano inferiori al previsto rispetto agli standard globulari [tireoglobulina (670 kDa), -globulina (158 kDa), ovoalbumina (44 kDa), e mioglobina (17 kDa)], corrispondente a MW di 50 e 46 kDa per N-FATZ-1 e Δ91-FATZ-1, rispettivamente. UV, ultravioletto. (F) Grafici Kratky adimensionali di N-FATZ-1 e Δ91-FATZ-1, nonché di albumina sierica bovina globulare (BSA) (codice SASBDB SASDFQ8). Dati sperimentali di scattering di raggi X a piccolo angolo SEC (SAXS) di N-FATZ-1 (G) e Δ91-FATZ-1 (I) e adattamento corrispondente ai dati di ensemble selezionati ottenuti dal metodo di ottimizzazione dell'insieme (EOM). Le distribuzioni Rg di insiemi selezionati rispetto alla distribuzione di un pool casuale sono mostrate nei riquadri. Rappresentanti del modello degli ensemble EOM selezionati per N-FATZ-1 (H) e Δ91-FATZ-1 (J), insieme al loro Rg (in nanometri) e frazioni di volume (in percentuale). Credito:progressi scientifici, doi:10.1126/sciadv.abg7653
L'alfa-actina può reticolare i filamenti di actina e ancorarli al disco Z nei sarcomeri. I sarcomeri sono un'unità strutturale della miofibrilla nel muscolo striato. Il FATZ (filamina, La proteina che lega l'α-actinina e la teletonina del disco Z) può interagire con l'α-actinina e altre proteine del disco Z del nucleo che contribuiscono all'assemblaggio e al mantenimento delle miofibrille. In un nuovo rapporto ora su Progressi scientifici , Antonio Sponga e un gruppo di ricerca internazionale in Austria, Germania, Russia, La Polonia e il Regno Unito hanno dettagliato la prima struttura e la convalida cellulare del complesso α-actinina-2 con un partner del disco Z, FATZ-1, formare un insieme conforme. Il FATZ-1 ha formato un complesso fuzzy stretto con α-actinina-2 con un meccanismo di interazione proposto tramite elementi di riconoscimento molecolare e siti di legame secondari. Il modello integrativo ottenuto ha rivelato un'architettura polare del complesso in combinazione con la funzione di scaffold multivalente FATZ-1 per organizzare i partner di interazione e stabilizzarsi.
sarcomero
I muscoli che si contraggono possono regolare il movimento volontario dell'animale e il battito cardiaco involontario, e i sarcomeri sono le unità contrattili di base delle cellule muscolari striate. Sono composti da matrici di filamenti sottili (actina) e spessi (miosina) che scorrono l'uno sull'altro durante la contrazione. Il disco Z può formare il confine tra sarcomeri adiacenti, dove sono ancorati i filamenti di actina antiparallelo. Una struttura di ancoraggio adeguatamente stabile deve essere generata dall'interazione tra miosina e actina. Lo Z-disk può svolgere questo ruolo fungendo da hub meccanico e piattaforma di segnalazione per consentire la trasmissione della tensione durante la contrazione e la durata e la trasmissione di informazioni di stress biomeccanico. Di conseguenza, qualsiasi mutazione che interrompa l'architettura e la funzione del disco Z potrebbe rischiare di causare disfunzioni scheletriche e cardiache.
Il complesso proteico
L'alfa-actina è una proteina reticolante di F-actina nei dischi Z muscolari, che forma un importante componente del disco Z che reticola i filamenti di actina antiparalleli dai sarcomeri adiacenti per fungere da piattaforma di legame per più proteine del disco Z, compreso FATZ-1. Le proteine FATZ possono legarsi all'α-actinina attraverso la loro regione c-terminale e ai domini dei membri della famiglia Enigma tramite uno specifico motivo di riconoscimento c-terminale. In questo lavoro, Antonio Sponga et al. ha dimostrato come le proteine FATZ contenessero regioni intrinsecamente disordinate (IDR) meglio descritte come un insieme conformazionale, meno stabili e privi di una struttura terziaria stabile. Oltre ai metodi di caratterizzazione biofisica, il team ha utilizzato la cristallografia a raggi X e lo scattering di raggi X a piccolo angolo per descrivere un complesso α-actinina-2/FATZ-1 "sfocato". La proteina FATZ-1 può svolgere un ruolo organizzativo nel disco Z grazie alle sue proprietà multivalenti di scaffolding e formare un complesso stretto di architettura polare con α-actinina-2.
FATZ-1 forma un complesso 2:1 stretto con il dimero α-actinina-2 attraverso più siti di legame. (A) Schemi dei costrutti α-actinina-2, insieme ai loro confini amminoacidici e alla composizione del dominio. Analisi SEC-MALS per l'interazione di FATZ-1, FATZ-2, e FATZ-3 con α-actinina-2 (B), N-FATZ-1 con bastoncino-α-actinina-2 (C), Δ91-FATZ-1 con hd-α-actinina-2 (D), e cinqueE Δ91-FATZ-1 mutante con α-actinina-2 (E). Analisi ITC per l'interazione di Δ91-FATZ-1 con α-actinina-2 (F), N-FATZ-1 con bastoncello-α-actinina-2 (G), Δ91-FATZ-1 con hd-α-actinina-2 (H), e cinqueE Δ91-FATZ-1 mutante con α-actinina-2 (I). ns., non determinato. (J) rapporto di intensità del segnale HSQC 1H-15N di 15N Δ91-FATZ-1 legato/libero, mappatura del sito di legame primario FATZ-1 per l'α-actinina-2. La parte non assegnata in FATZ-1 è riquadrata, e i residui sono tracciati in una posizione casuale. (K) Sequenza di FATZ-1 che mostra più siti di interazione per α-actinina-2 come determinato dall'array di peptidi (residui quadrati), XL-MS (stella), LP-MS (residui delimitati da frecce), e NMR (frecce). I residui che corrispondono al peptide segnale più forte nell'array di peptidi sono mostrati in grassetto. I confini per Δ91-FATZ-1 e mini-FATZ-1 sono delimitati da frecce. Le mutazioni entro cinqueE Δ91-FATZ-1 e RRE Δ91-FATZ-1 sono indicate in arancione e ciano scuro, rispettivamente. Credito:progressi scientifici, doi:10.1126/sciadv.abg7653 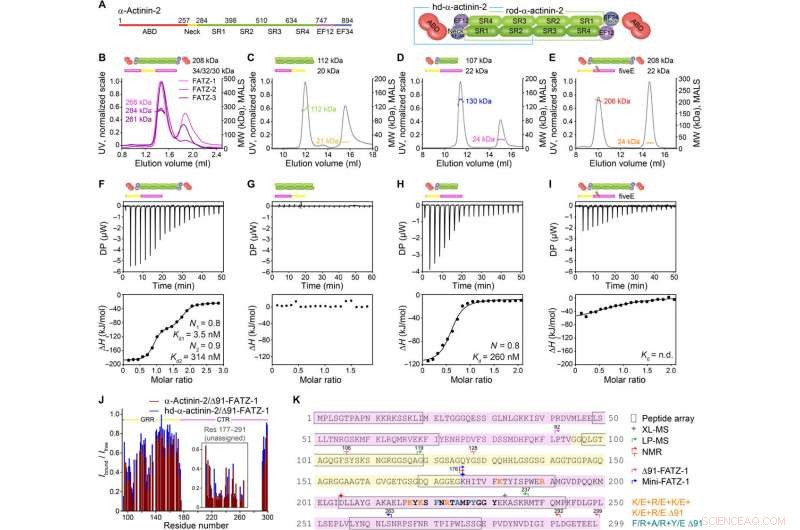
La famiglia di proteine FATZ si trova in tutti i vertebrati in cui FATZ-1 umano, FATZ-2, e FATZ-3 condividono dal 34 al 40 percento di identità di sequenza. Gli scienziati hanno riconosciuto frammenti resistenti alla proteolisi, dopo aver condotto esperimenti di proteolisi. Quando hanno combinato la cromatografia ad esclusione dimensionale (SEC) con la diffusione della luce multiangolo, hanno notato i monomeri predominanti in condizioni sperimentali. Hanno quindi ulteriormente caratterizzato i monomeri utilizzando SEC combinato con la diffusione di raggi X ad angolo ridotto e hanno anche evidenziato la natura intrinsecamente disordinata/stato d'insieme dei monomeri utilizzando spettri di coerenza quantistica singola (HSQC), per entrambi i costrutti. Per comprendere la stechiometria di legame delle proteine FATZ-1-to-3 all'α-actinina-2, Sponga et al. cromatografia ad esclusione dimensionale-scattering multiangolo di luce (SEC-MALS). Per caratterizzare la stechiometria di legame delle proteine FATZ-1-to-3 all'α-actinina-2, Sponga et al. usato SEC-MALS. Il risultato ha mostrato come ciascuna delle tre proteine FATZ formasse un complesso stretto con α-actinina-2, con una stechiometria di legame di due molecole di FATZ per dimero di α-actinina-2. Questa è una molecola FATZ per subunità α-actinina-2. Il team ha poi utilizzato la calorimetria isotermica di titolazione (ITC) per quantificare l'affinità di interazione.
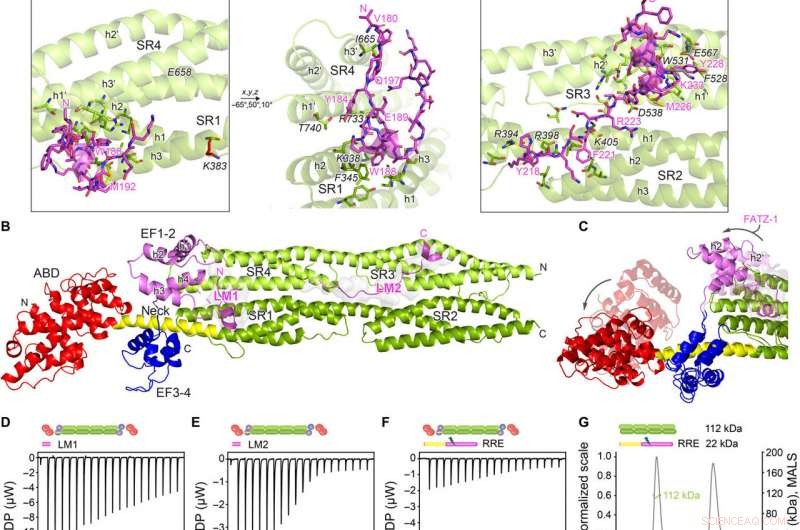
Le strutture cristalline di α-actinina-2/FATZ-1 rivelano due motivi di legame lineari in FATZ-1. (A) Struttura cristallina di bastoncello-α-actinina-2/mini-FATZ-1 (in verde/magenta), insieme alla sequenza di consenso FATZ-1 determinata (dal 35 all'80% e dal 60 all'84% di identità di sequenza a coppie per LM1 e LM2, rispettivamente). I residui reticolati sono indicati in blu, rosso, e stelle/palline/bastoncini grigi sulla sequenza/struttura. I Se-Met identificati sono mostrati in giallo. Il dimero rod-α-actinina-2 è assemblato attraverso un doppio asse cristallografico tra i compagni di simmetria (cerchio nero). Residui interagenti (rod-α-actinin-2 in corsivo), insieme alle eliche da SR1/SR2 (h1, h2, e h3) e SR3/SR4 (h1′, h2′, e h3′), sono mostrati in viste ravvicinate. (B) Struttura cristallina di hd-α-actinin-2/Δ91-FATZ-1 (LM1 e LM2 come cartone magenta e superficie grigia trasparente; hd-α-actinin-2 con codice colore come in Fig. 2A). (C) Confronto tra [Banca dati proteica (PDB) codice 4D1E] non legato e legato (questo lavoro) hd-α-actinina-2. ABD ed EF1-2 di hd-α-actinina-2 non legata sono mostrati con trasparenza. Analisi ITC per l'interazione del peptide LM1 con α-actinina-2 (D), Peptide LM2 con α-actinina-2 (E), e mutante RRE Δ91-FATZ-1 con α-actinina-2 (F). Analisi SEC-MALS per l'interazione del mutante RRE Δ91-FATZ-1 con rod-α-actinin-2 (G) e Δ91-FATZ-1 con E. histolytica rod-α-actinin-2 (H). Credito:progressi scientifici, doi:10.1126/sciadv.abg7653
Siti di legame multipli per il complesso proteico
Il team ha notato come FATZ-1 ha interagito con l'α-actinina-2 attraverso più siti di legame. Per restringere i siti di legame FATZ-1, Sponga et al. utilizzato proteolisi limitata e reticolazione chimica accoppiata con spettrometria di massa sul complesso proteico. Per poi favorire la cristallizzazione di questo complesso proteico, il team ha poi anche combinato le informazioni dalla matrice di peptidi e ha generato un costrutto più breve noto come mini-FATZ-1 per ulteriori studi sulla loro biologia strutturale. Gli scienziati hanno quindi convalidato i modelli sfocati sviluppati nel lavoro utilizzando la viscosità intrinseca calcolata e derivata sperimentalmente, un parametro idrodinamico della conformazione delle proteine. Per comprendere quindi il contributo dell'α-actinina-2 nel localizzare le proteine FATZ sul disco Z del sarcomero, Sponga et al. proteine FATZ-1 o FATZ-2 marcate con GFP trasfettate in mioblasti di topo immortalati o cardiomiociti neonatali di ratto. Entrambe le proteine FATZ-1 e -2 hanno preso di mira correttamente il disco Z e si sono co-localizzate con l'α-actinina-2.
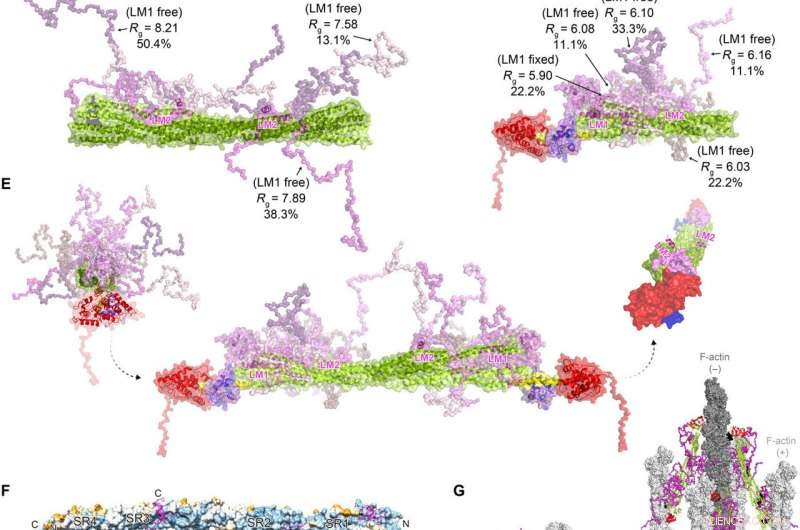
FATZ-1 forma un complesso sfocato con α-actinina-2 con conseguente architettura polare del complesso. Dati sperimentali SAXS di rod-α-actinin-2/Δ91-FATZ-1 (A) e hd-α-actinin-2/Δ91-FATZ-1 (B), con il modello corrispondente si adatta ai dati degli ensemble selezionati. GAJOE, Algoritmo genetico che giudica l'ottimizzazione degli ensemble. Regioni flessibili di Δ91-FATZ-1, non visibile nelle nostre determinate strutture cristalline, sono stati generati con EOM mantenendo LM1 fisso o libero (10, 000 modelli per ciascuno). Rappresentanti del modello di ensemble selezionati per rod-α-actinin-2/Δ91-FATZ-1 (C) e hd-α-actinin-2/Δ91-FATZ-1 (D) , insieme alle loro frazioni Rg e di volume all'interno dell'ensemble. (E) Modello integrativo di fuzzy α-actinin-2/Δ91-FATZ-1 costruito utilizzando la cristallografia a raggi X e modelli SAXS di hd-α-actinin-2/Δ91-FATZ-1. Rotazione per le eliche LM2 delle molecole FATZ-1 legate l'una rispetto all'altra, così come la torsione torsionale dell'asta lungo l'asse longitudinale dell'α-actinina-2, è mostrato nel riquadro di destra (le parti flessibili FATZ-1 sono state omesse per chiarezza). (F) Superficie della struttura dell'asta-α-actinina-2/FATZ-1 che mostra la conservazione della sequenza dei residui interagenti α-actinina per FATZ-1 (allineamento eseguito utilizzando 1505 α-actinine da vertebrati). (G) Modello di F-actina/α-actina-2/FATZ-1 (F-actina in grigio chiaro e scuro) basato su una struttura di tomografia crio-elettronica del disco Z e sul modello integrativo. Credito:progressi scientifici, doi:10.1126/sciadv.abg7653
Veduta
In questo modo, Antonio Sponga e colleghi hanno descritto come l'assemblaggio del sarcomero sia iniziato da corpi Z di α-actinina-2, includere proteine come FATZ, miotilina, e actina, per dirne alcuni. Il risultato indica che le proteine della famiglia FATZ sono disponibili nei corpi Z e nei dischi Z maturi con un ruolo nelle vie di segnalazione proteica per legare la calcineurina. Il team ha evidenziato il ruolo di FATZ-1, il membro della famiglia più studiato e la sua interazione con la principale proteina del disco Z α-actinina-2. La struttura e il meccanismo di legame del complesso sfocato α-actinina-2/FATZ-1 hanno supportato la funzione FATZ-1 come classica proteina di scaffold nell'assemblaggio del disco Z. Ulteriori studi riveleranno se gli stessi principi si applicano in condizioni fisiologiche nelle cellule viventi.
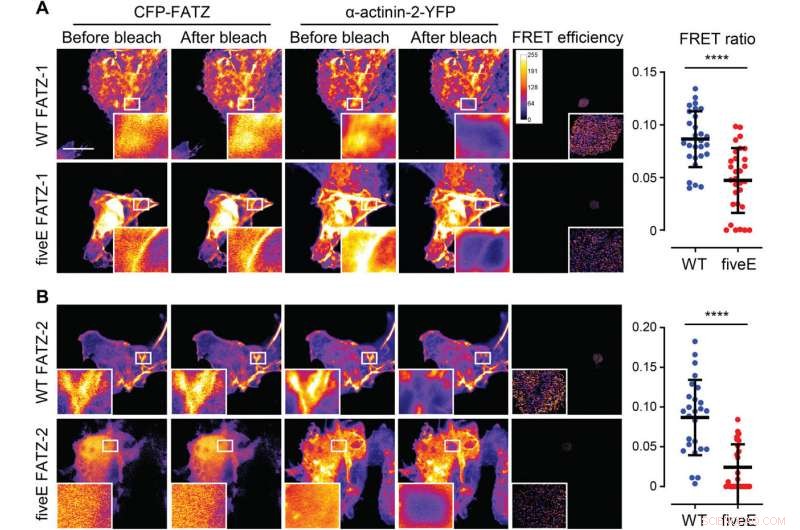
L'α-Actinina-2 stabilizza le proteine FATZ sul disco Z. (A) cellule COS-1 che coesprimono FATZ-1 (WT FATZ-1) con CFP potenziata (ECFP) o corrispondente mutante fiveE, in combinazione con actinin-2-EYFP, come determinato in celle fisse mediante photobleaching dell'accettore. Le immagini rappresentative sono mostrate prima e dopo lo sbiancamento per entrambe le proteine. Vengono mostrate le regioni di interesse sbiancate (riquadri), insieme alle efficienze FRET utilizzate per calcolare i rapporti FRET presentati nel grafico adiacente [n =28 (WT) e 30 (cinqueE), ****P <0,0005, Test t di studente). (B) Stesse cellule di (A) ma coesprimono varianti FATZ-2 etichettate con ECFP in combinazione con EYFP-α-actinina-2 [n =26 (WT) e 25 (cinqueE), ****P <0,0005, Test t di studente). Barre della scala, 10 μm in tutte le immagini. Credito:progressi scientifici, doi:10.1126/sciadv.abg7653
© 2021 Science X Network