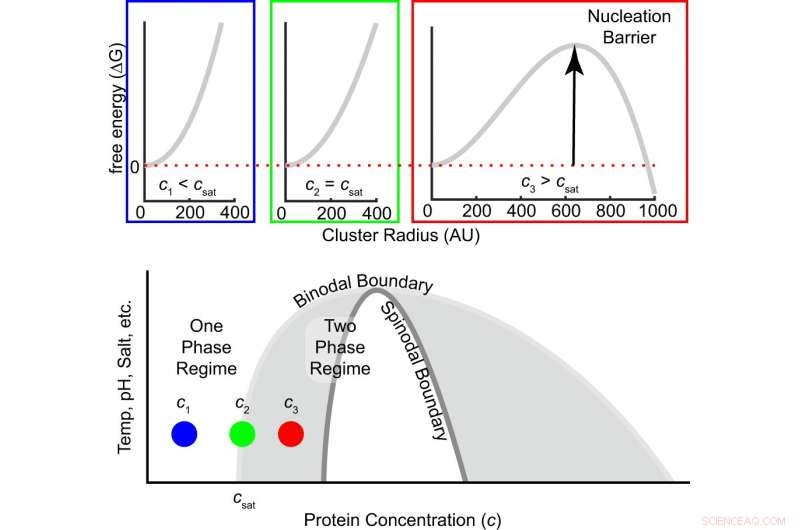
Fig. 1:La barriera di energia libera alla nucleazione dipende dal grado di sovrasaturazione. L'energia libera in funzione della dimensione del cluster è mostrata in alto per tre concentrazioni, cioè., sotto, uguale e superiore alla concentrazione di saturazione. All'aumentare della concentrazione da subsatura a concentrazione di saturazione a supersatura, il segno della differenza di energia libera tra una molecola all'interno e all'esterno di un cluster cambia da positivo a negativo, ed emerge una barriera di nucleazione finita (Eq. (1)). La regione grigia all'interno del binocolo è metastabile, il che significa che la nucleazione è necessaria per formare cluster di fase densa che crescono fino a raggiungere l'equilibrio. Il regime bianco all'interno dello spinodal è instabile, il che significa che la soluzione si decompone spontaneamente in fasi diluite e dense. Credito:DOI:10.1038/s41467-021-24727-z
Gli scienziati del St. Jude Children's Research Hospital stanno studiando la separazione di fase liquido-liquido (LLPS), un processo biofisico attraverso il quale le proteine e gli acidi nucleici in una cellula sono compartimentati senza una membrana. Il lavoro fornisce nuove informazioni su come la forza delle forze che guidano la separazione di fase sia collegata alla velocità con cui si verifica. I risultati sono stati pubblicati oggi in Comunicazioni sulla natura .
Le cellule hanno bisogno di ordinare e organizzare proteine e altri componenti. Un modo per farlo è tramite LLPS, un processo simile al modo in cui l'olio forma le goccioline nell'acqua. organelli senza membrana, corpi in una cellula che si comportano come goccioline liquide, organizzare determinate proteine senza racchiuderle con una membrana. Anziché, le proteine sono tenute insieme dalle forze biofisiche che guidano la LLPS.
Poco si sa su come le biomolecole passano da una soluzione a una fase a una miscela a due fasi, in un processo chiamato nucleazione. Questo processo è stato difficile da valutare perché richiede l'analisi di scale temporali estremamente veloci (da microsecondi a millisecondi). Di conseguenza, la maggior parte degli studi ha invece esaminato l'evoluzione all'interno di sistemi che sono già in regime a due fasi (come le goccioline si fondono e crescono).
"Possiamo vedere durante questi primissimi momenti che anche singole molecole proteiche disordinate che si separano in fase hanno proprietà molto diverse rispetto alle proteine disordinate che non si separano in fase, " ha detto l'autore corrispondente Tanja Mittag, dottorato di ricerca, St. Jude Dipartimento di Biologia Strutturale.
La ricerca al St. Jude e altrove ha dimostrato che la LLPS può essere coinvolta in malattie neurodegenerative come la sclerosi laterale amiotrofica (SLA) e il cancro. Una migliore comprensione di LLPS può in definitiva portare a opportunità per mirare terapeuticamente a parti del processo.
Le misurazioni del tempo in microsecondi danno una nuova comprensione
La visione prevalente di LLPS in biologia è stata che un cambiamento nelle condizioni cellulari può portare spontaneamente alla nucleazione, commutazione di una soluzione monofase in due fasi. In questa ricerca, gli scienziati hanno utilizzato un sistema semplificato, con una sola proteina in acqua e sale, per studiare se il passaggio si è effettivamente verificato in questo modo o se sono necessari passaggi aggiuntivi per avviare il processo.
Con una tecnica chiamata miscelazione rapida, risolta nel tempo, diffusione di raggi X a piccolo angolo (TR-SAXS), i ricercatori hanno potuto osservare le prime fasi del processo. Hanno esaminato la nucleazione di un dominio simile al prione chiamato A1-LCD dalla proteina hnRNPA1. Le mutazioni di questa proteina causano la SLA e altre malattie.
Gli scienziati hanno mostrato come si formano i cluster di A1-LCD, e come questi cluster portano a LLPS. I risultati indicano che la nucleazione contiene passaggi distinti, differenziato per la dimensione del cluster. Quando si osservano i cluster più piccoli (con poche singole molecole), gli scienziati hanno scoperto che il comportamento dell'assemblaggio differiva dalla teoria della nucleazione classica. Queste deviazioni potenzialmente spiegano perché la separazione di fase di alcune biomolecole può avvenire in millisecondi mentre per altre ci vogliono ore.
"Anche in un sistema semplificato, devi ancora prendere in considerazione questo tipo di effetti non ideali nelle prime fasi della nucleazione, ", ha affermato l'autore corrispondente Erik Martin, dottorato di ricerca, St. Jude Dipartimento di Biologia Strutturale. "Prima di iniziare a pensare all'assemblaggio a separazione di fase o alla condensazione nelle celle, devi pensare alle cose a livello molecolare. Ci saranno passaggi iniziali per quell'assemblaggio che non sono stati presi in considerazione nei modelli precedenti".