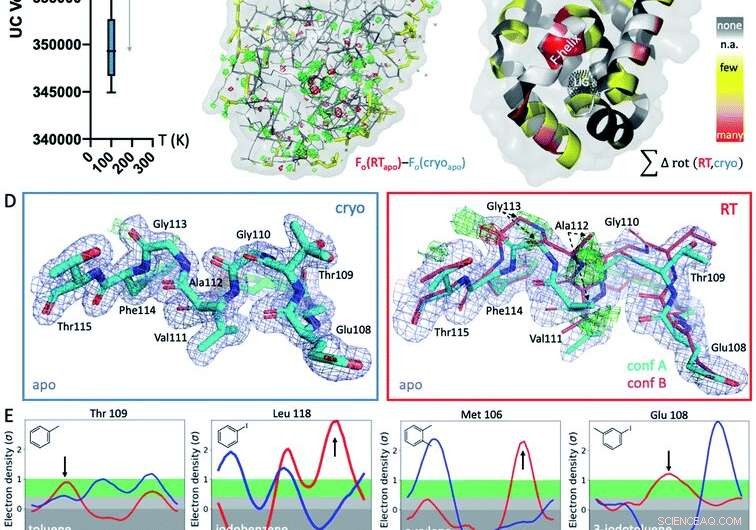
Fig. 1 Risposte strutturali globali e locali alla temperatura. (A) Globalmente, le strutture a temperatura criogenica (crio; grafico blu) sono più variabili e più compatte rispetto ai loro equivalenti a temperatura ambiente (TA; grafico rosso), come mostrato dai volumi medi delle celle unitarie (UC) su 9 strutture abbinate raccolte a entrambe le temperature. (B) La mappa isomorfa Fo - Fo della struttura apo raccolta a crio rispetto a RT mostra differenze nella densità elettronica (maglia verde, densità elettronica a differenza positiva; maglia rossa, densità elettronica a differenza negativa) che indicano effetti di temperatura idiosincratici, specialmente intorno al sito di legame del ligando nel lobo inferiore, indicato dalla rete tratteggiata nera nel pannello C (etichettato LIG). (C) Il verificarsi di differenze rotameriche dipendenti dalla temperatura tra tutte e 9 le strutture viene proiettato sui rispettivi residui nella struttura apo T4L; colorato dalla sensibilità alla temperatura di ciascun residuo su tutte e 9 le coppie di strutture:giallo per poche strutture, arancione per più strutture, e rosso per la maggior parte delle strutture che mostrano differenze di temperatura del residuo; le macchie bianche sono Gly e Ala che non hanno angoli di Chi; e le macchie grigie non mostrano alcun cambiamento del rotamero con la temperatura. (D) Localmente, I dati RT della cavità apo L99A rivelano una conformazione alternativa dell'elica F (conf. B) nelle mappe di densità elettronica della differenza Fo - Fc (maglia verde e rossa per densità positiva e negativa, rispettivamente; solo la conformazione ciano A è stata inclusa nel raffinamento) che non è visibile al crio; 2mFo − mappa DFc mostrata come maglia blu; lo spessore del bastone rappresenta l'occupazione relativa. (E) Tutti gli 8 complessi di ligandi mostrano uno spostamento nell'orientamento preferito in risposta alla temperatura piuttosto che a causa del legame del ligando per almeno 1 rotamero residuo nell'elica F vicino al sito di legame del ligando. Ringer plot per residui selezionati, con differenze di rotamer a RT (rosso) rispetto a cryo (blu) indicate dalle frecce. Credito:DOI:10.1039/D1SC02751D
Circa il 95% di tutte le strutture cristalline ottenute per varie proteine e depositate in database pubblici vengono catturate utilizzando la tecnologia criogenica. Questa tecnologia richiede condizioni congelate. Gli scienziati del St. Jude Children's Research Hospital hanno confrontato le strutture criogeniche con quelle osservate a temperatura ambiente. Le scoperte, pubblicato oggi in Scienze chimiche , indicare che il congelamento può introdurre errori, causare la perdita di determinate conformazioni (forme) e portare a imprecisioni nei modelli computazionali.
Le strutture proteiche sono essenziali per il processo di sviluppo dei farmaci perché forniscono una mappa su come dovrebbero essere progettati i farmaci mirati.
"Dobbiamo ripensare a come raccogliamo, analizzare e utilizzare le informazioni strutturali quando ci proponiamo di scoprire molecole bioattive, " ha detto l'autore corrispondente Marcus Fischer, dottorato di ricerca, St. Jude Dipartimento di Biologia Chimica e Terapia. "Puoi vedere la temperatura come una manopola sperimentale che possiamo girare per esplorare le conformazioni proteiche nascoste".
La temperatura fa la differenza
I ricercatori hanno dimostrato che il congelamento distorce le conformazioni che assumono le proteine, spesso introducendo errori nelle strutture. Il team ha anche scoperto che alcune conformazioni che si verificano a temperatura ambiente possono essere perse se si osservano solo i risultati delle tecniche criogeniche.
I ricercatori hanno condotto una valutazione sistematica delle strutture criogeniche, a partire dalla cavità del lisozima T4 L99A. Questa proteina è considerata un "cavallo di battaglia" in biologia strutturale per comprendere la stabilità delle proteine, rigidità e termodinamica di legame. Il passaggio alla temperatura ambiente ha rivelato nuovi cambiamenti strutturali che sono stati persi per decenni.
Il team ha testato quattro classi aggiuntive di proteine. I risultati si sono mantenuti veri indipendentemente dal tipo di proteina valutata.
"Quando esci d'inverno e hai freddo, ti comprimi e ti rimpicciolisci su te stesso, e al sole quando hai caldo ti stendi. Le proteine fanno lo stesso, " ha detto Fischer.
Evitare errori
I metodi computazionali sono algoritmi che i ricercatori utilizzano per fare previsioni o valutare i dati ottenuti dai loro esperimenti. I risultati indicano che quando questi metodi sono costruiti su dati provenienti da strutture criogeniche, possono essere introdotti errori che potrebbero alterare i risultati futuri.
Le tecniche criogeniche sono state a lungo favorite perché facilitano l'ottenimento delle strutture. Ottenere strutture a temperatura ambiente è più noioso. Sebbene ci siano modi per mitigare questi problemi, fattori come la completezza dei dati e il danno da radiazioni sono ulteriori ostacoli per molti ricercatori nell'ottenere strutture a temperatura ambiente.
Mentre il rilevamento di una forma proteica nascosta è informativo, mancava ancora la dimostrazione dell'impatto della nuova forma sui protocolli di scoperta dei farmaci.
"Abbiamo visto che la proteina ha adottato uno stato per interagire con i ligandi, e che le informazioni mancanti possono aiutare a migliorare l'accuratezza dello screening virtuale dei farmaci e delle simulazioni di interazione proteina-ligando, " ha detto il co-primo autore Shanshan Bradford, dottorato di ricerca, St. Jude Dipartimento di Biologia Chimica e Terapia.
I ricercatori sottolineano che quando si considerano solo le strutture criogeniche, non c'è modo di sapere se ci sono errori, ma quel confronto con le strutture a temperatura ambiente può aiutare a chiarire le informazioni e potenzialmente a rivelare ulteriori approfondimenti che altrimenti non sarebbero noti.