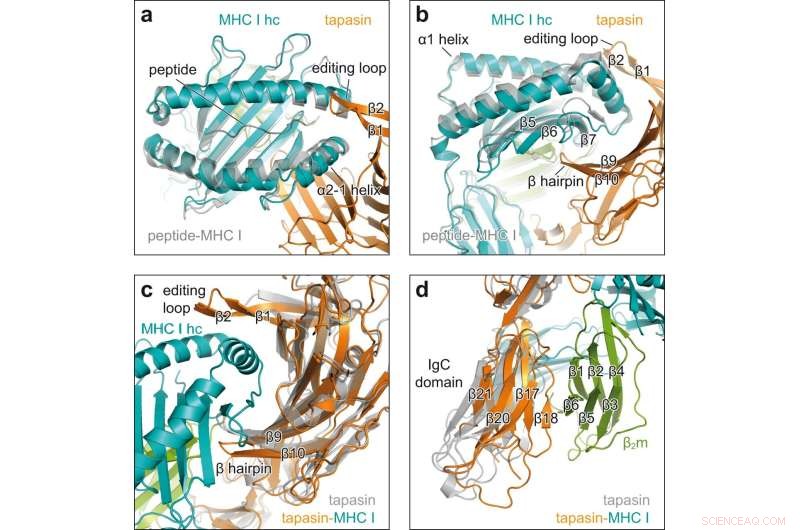
Cambiamenti conformazionali in seguito al coinvolgimento del cliente-accompagnatore. a Vista dall'alto della sovrapposizione dell'MHC I recettivo ai peptidi nel complesso chaperone (MHC I hc, teal; tapasin, arancione) con H2-D legato al peptide b (grigio, PDB ID 2F74) nella rappresentazione di cartoni animati. catena pesante hc; β1, β2, β fili del ciclo di editing di tapasin. b Vista laterale della sovrapposizione mostrata in un filamento β5, β6, β7, β di MHC I hc; β9, β10, β tornante di tapasin. c Vista sull'interfaccia concava della tapasin in sovrapposizione della tapasin legata a MHC I dal complesso chaperone (tapasin, arancione; MHC I hc, verde acqua; β2m, verde) con tapasin senza client (grigio, PDB ID 3F8U). d Sovrapposizione come in c ma vista sul dominio C-terminale della tapasin. Dominio costante dell'immunoglobulina del dominio IgC, β2 mβ2 -microglobulina. Credito:Comunicazioni sulla natura (2022). DOI:10.1038/s41467-022-32841-9
In quanto task force del sistema immunitario adattativo, i linfociti T sono responsabili dell'attacco e dell'uccisione delle cellule infette o cancerose. Tali cellule, come quasi tutte le cellule del corpo umano, presentano sulla loro superficie frammenti di tutte le proteine che producono al loro interno. Se questi includono peptidi che un linfocita T riconosce come estranei, il linfocita viene attivato e uccide la cellula in questione.
È quindi importante per una robusta risposta dei linfociti T che frammenti proteici adatti siano presentati al linfocita T. Il team di ricerca guidato da Simon Trowitzsch e Robert Tampé dell'Istituto di Biochimica della Goethe University di Francoforte ha ora fatto luce su come la cellula seleziona questi frammenti proteici o peptidi.
La presentazione dei peptidi avviene sulle cosiddette molecole di classe I del complesso maggiore di istocompatibilità (MHC I). Le molecole MHC I sono un gruppo di proteine di superficie molto diverse che possono legare miriadi di peptidi diversi. Sono ancorati nella membrana cellulare e formano una tasca di legame dei peptidi con la loro parte rivolta verso l'esterno.
Come tutte le proteine di superficie, le molecole MHC I prendono la cosiddetta via secretoria:vengono sintetizzate nel sistema della cavità cellulare (reticolo endoplasmatico (RE) e apparato di Golgi) e lì ripiegate. Piccole vescicole quindi germogliano dal sistema di cavità, migrano verso la membrana cellulare e si fondono con essa.
Il processo di maturazione delle molecole MHC I è strettamente controllato:nell'ER, le proteine note come "chaperones" le aiutano a ripiegarsi. Il tapasin chaperone è essenziale per il caricamento del peptide in questo processo.
"Quando una molecola MHC I ha legato un peptide, la tapasin controlla quanto sia stretto il legame", afferma Trowitzsch, spiegando il compito dell'accompagnatore. "Se il legame è instabile, il peptide viene rimosso e sostituito da uno strettamente vincolante". Tuttavia, non è stato ancora possibile chiarire in che modo esattamente tapasin svolga questo compito, soprattutto perché il processo di caricamento è estremamente veloce.
I biochimici ei biologi strutturali dell'Università Goethe di Francoforte sono ora riusciti per la prima volta a visualizzare l'interazione di breve durata tra chaperone e la molecola MHC I mediante l'analisi della struttura dei raggi X.
Per fare ciò, hanno prodotto varianti dei due partner di interazione che non erano più incorporati nella membrana, le hanno purificate e le hanno unite. Un trucco ha aiutato a catturare il complesso di caricamento in azione per la cristallizzazione:in primo luogo, il team di ricerca ha caricato la molecola MHC I con un peptide ad alta affinità in modo da creare un complesso stabile.
Un segnale luminoso ha innescato la scissione del peptide, che ha notevolmente ridotto la sua capacità di legare la molecola MHC I. Immediatamente, la tapasin è entrata in scena ed è rimasta legata alla molecola MHC I priva del suo peptide. "La scissione fotoindotta del peptide è stata fondamentale per il successo del nostro esperimento", afferma Tampé. "Con l'aiuto di questa biologia optochimica, ora possiamo riprodurre sistematicamente processi cellulari complessi uno per uno."
L'analisi della struttura a raggi X dei cristalli ha rivelato come la tapasin allarghi la tasca di legame del peptide della molecola MHC I, testando così la forza del legame peptidico. A tal fine, i partner di interazione formano un'ampia area di contatto; per la stabilizzazione, un anello di tapasin si trova sopra la tasca per rilegatura allargata.
"Questa è la prima volta che mostriamo il processo di caricamento ad alta risoluzione", afferma Tampé. Le immagini rivelano anche come un singolo accompagnatore può interagire con l'enorme diversità delle molecole MHC I, afferma il biochimico. "La tapasin lega precisamente le regioni non variabili delle molecole MHC I". Tuttavia, la nuova struttura non solo migliora la nostra comprensione dei complessi processi coinvolti nel caricamento delle molecole MHC I. Dovrebbe anche aiutare a selezionare candidati idonei per lo sviluppo del vaccino.
La ricerca è stata pubblicata su Nature Communications . + Esplora ulteriormente