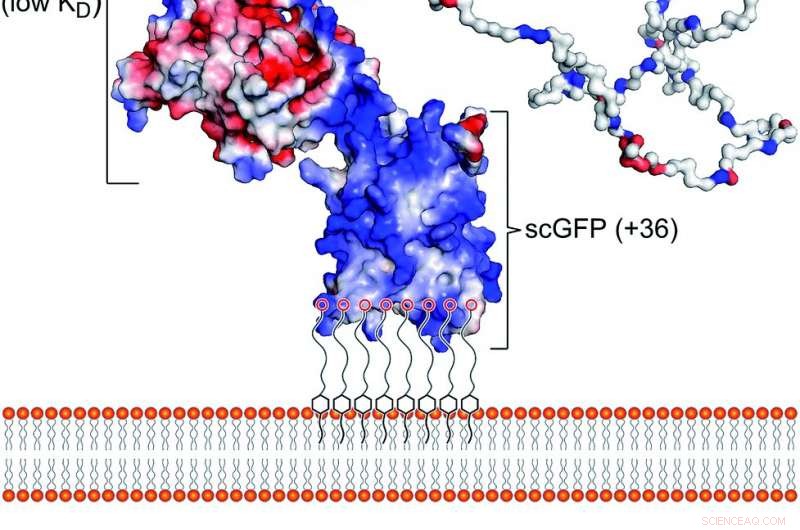
Fig. 1 Il costrutto di legame artificiale della membrana plasmatica. (a) Schema che mostra l'interazione del costrutto di fusione sovralimentata coniugato con tensioattivo polimerico [CshA_scGFP][S] con il doppio strato della membrana citoplasmatica. La struttura mostra il potenziale di carica superficiale, evidenziando l'elevata carica positiva (blu) sul dominio GFP sovralimentato e la carica negativa (rosso) sul dominio globulare CshA, così come i domini "catch" e "clamp" di CshA. (b) La struttura del polimero anionico tensioattivo acido glicolico etossilato 4-nonilfenil etere (S), che complessi elettrostaticamente con la porzione GFP sovralimentata. Credito:scienza chimica, accesso aperto:https://pubs.rsc.org/en/content/articlelanding/2019/sc/c9sc02650a#!divAbstract
In una prima mondiale, gli scienziati hanno trovato un nuovo modo per dirigere le cellule staminali verso il tessuto cardiaco. Le scoperte, guidato da ricercatori dell'Università di Bristol e pubblicato in Scienze chimiche , potrebbe migliorare radicalmente il trattamento per le malattie cardiovascolari, che causa più di un quarto di tutti i decessi nel Regno Unito.
Ad oggi, sperimentazioni con cellule staminali, che vengono prelevati e coltivati dal paziente o dal donatore e iniettati nel cuore del paziente per rigenerare il tessuto danneggiato, hanno prodotto risultati promettenti.
Però, mentre queste terapie cellulari di nuova generazione sono all'orizzonte, sono rimaste sfide significative associate alla distribuzione delle cellule staminali. Flusso sanguigno elevato nel cuore combinato con vari "pozzi tissutali", "con cui le cellule circolanti entrano in contatto, significa che la maggior parte delle cellule staminali finisce nei polmoni e nella milza.
Ora, i ricercatori della School of Cellular and Molecular Medicine di Bristol hanno trovato un modo per superare questo problema modificando le cellule staminali con una proteina speciale in modo che "sedano" nel tessuto cardiaco.
Dottor Adam Perriman, l'autore principale dello studio, professore associato in Biomateriali, UKRI Future Leaders Fellow e fondatore della società di tecnologie per la terapia cellulare CytoSeek, ha spiegato:"Con le terapie cellulari rigenerative, dove stai cercando di curare qualcuno dopo un attacco di cuore, le cellule raramente vanno dove vuoi che vadano. Il nostro obiettivo è utilizzare questa tecnologia per riprogettare la membrana delle cellule, in modo che quando vengono iniettati, ospiteranno tessuti specifici di nostra scelta.
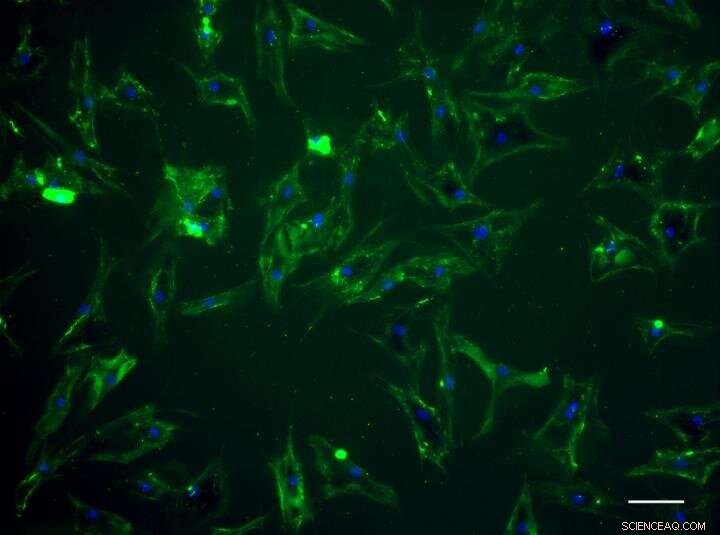
Gli steli mesenchimali umani mostrano una fluorescenza verde dopo essere stati "dipinti" dalla proteina designer. Credito:Università di Bristol
"Sappiamo che alcune cellule batteriche contengono proprietà che consentono loro di rilevare e "sedersi" nei tessuti malati. Ad esempio, il batterio orale che si trova nella nostra bocca può occasionalmente causare mal di gola. Se entra nel flusso sanguigno, può "sedersi" nel tessuto danneggiato nel cuore causando endocardite infettiva. Il nostro obiettivo era replicare la capacità di homing delle cellule batteriche e applicarla alle cellule staminali".
Il team ha sviluppato la tecnologia esaminando il modo in cui le cellule batteriche utilizzano una proteina chiamata adesina per "sedersi" nel tessuto cardiaco. Usando questa teoria, i ricercatori sono stati in grado di produrre una versione dell'adesina che si lega alla membrana cellulare artificiale che potrebbe essere "dipinta" all'esterno delle cellule staminali. In un modello animale, il team è stato in grado di dimostrare che questa nuova tecnica di modificazione cellulare ha funzionato dirigendo le cellule staminali al cuore in un topo.
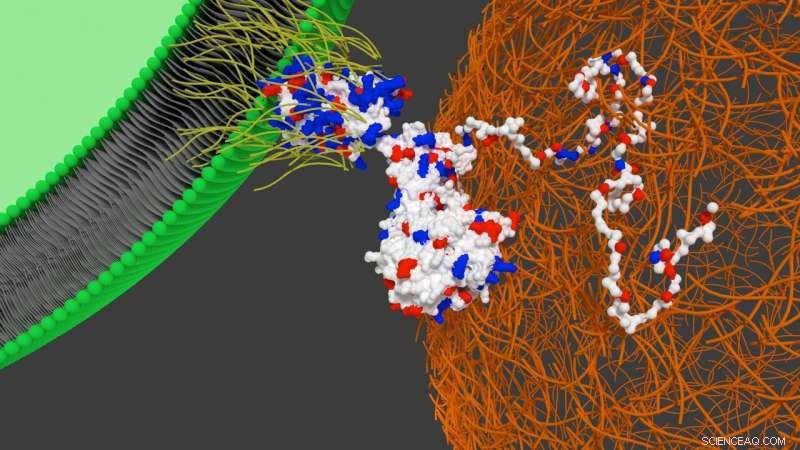
Schema che mostra l'interazione della proteina designer sulla superficie della cellula staminale con la fibronectina cardiaca. Credito:Università di Bristol
Il dott. Perriman ha aggiunto:"I nostri risultati dimostrano che le proprietà di homing cardiaco dei batteri infettivi possono essere trasferite alle cellule staminali umane. Significativamente, mostriamo in un modello murino che la proteina adesina designer si inserisce spontaneamente nella membrana plasmatica delle cellule staminali senza citotossicità, e quindi dirige le cellule modificate al cuore dopo il trapianto. Per quello che ci risulta, questa è la prima volta che le proprietà di targeting dei batteri infettivi sono state trasferite alle cellule di mammifero.
"Questa nuova tecnica ha un enorme potenziale per i sette milioni di persone che attualmente vivono con malattie cardiache nel Regno Unito".