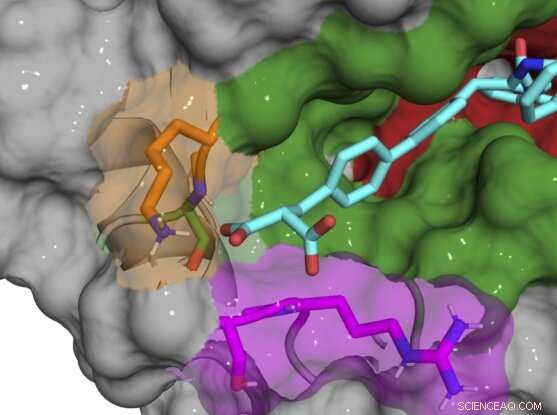
Struttura del co-cristallo a raggi X del composto B52 (ciano) che lega e inibisce la proteina della ciclofilina D. Credito:Aziz Rangwala
La ciclosporina è uno dei farmaci immunosoppressori più comuni ed efficaci usati per il trattamento di malattie croniche come l'artrite e la psoriasi, ma comporta il rischio di gravi effetti collaterali. Gli scienziati pensano che ciò possa essere dovuto al fatto che il farmaco prende di mira ampiamente le ciclofiline, una famiglia di 17 proteine regolatrici che svolgono ruoli diversi nella promozione della salute cellulare. Sebbene ogni singolo sottotipo di ciclofilina abbia un ruolo unico, molti farmaci immunosoppressori attuali prendono di mira l'intera famiglia, il che significa che importanti vie sconosciute possono essere disattivate accidentalmente o altrimenti alterate.
Il problema è complicato dal fatto che il sito attivo in cui le molecole si legano è quasi identico in tutte le 17 ciclofiline, il che rende difficile per i produttori di farmaci mirare a sottotipi specifici. In un articolo pubblicato oggi su Nature Chemical Biology , scienziati nel laboratorio del membro principale del Broad Institute David Liu, che è anche direttore del Merkin Institute of Transformative Technologies in Healthcare a Broad, in collaborazione con i laboratori di Markus Seeliger del SUNY Stony Brook e del membro dell'istituto Vamsi Mootha del Massachusetts General L'ospedale ha proposto una nuova soluzione.
Piuttosto che prendere di mira il sito attivo delle proteine della ciclofilina, i ricercatori del laboratorio di Liu descrivono un processo che trova composti che si legano al "sito exo", una piccola tasca accanto al sito attivo che varia per dimensioni e forma tra le diverse ciclofiline. Utilizzando proteine isolate in una provetta, il team ha scoperto diversi composti che legano e inibiscono esclusivamente la ciclofilina D (CypD), una proteina coinvolta nell'apertura e nella chiusura dei pori mitocondriali. Hanno anche applicato principi simili per scoprire inibitori selettivi unici per la ciclofilina E (CypE). Gli autori affermano che il loro studio pone le basi per consentire agli scienziati di sviluppare ulteriori inibitori della ciclofilina selettivi per sottotipi, alcuni dei quali potrebbero essere utili come strumenti per la biologia o come guide per lo sviluppo terapeutico.
"È una nuova modalità di rilegatura che sfrutta una tasca che le persone non hanno ancora completamente esplorato", ha affermato l'autore principale Alex Peterson, ora ricercatore post-dottorato presso lo Scripps Research Institute, che ha guidato il progetto come studente laureato nel laboratorio di Liu, . "È una specie di progetto su come le persone possono progettare inibitori selettivi della ciclofilina in futuro."
Utilizzare nuove e vecchie tecnologie
CypD regola i pori di transizione della permeabilità mitocondriale (mPTP), piccoli pori situati sulla superficie interna dei mitocondri (noto come la centrale elettrica della cellula). Quando CypD rileva lo stress ossidativo o livelli elevati di calcio, si precipita ad aprire l'mPTP, consentendo all'acqua e ad altri ioni di entrare e uscire di corsa dai mitocondri.
Questa apertura delle porte mitocondriali può diventare un problema con malattie come lesioni da ischemia da riperfusione, diabete, disturbi neurodegenerativi, malattie del fegato e altro ancora. Poiché queste condizioni possono causare livelli anormalmente elevati di stress ossidativo, CypD mantiene i pori mitocondriali aperti più a lungo del solito, causando disfunzione mitocondriale, rottura e morte cellulare. Si è pensato che i farmaci che rallentano e inibiscono la reazione della CypD a un elevato stress ossidativo potrebbero essere usati per curare una serie di malattie.
Per rintracciare i composti che si legano esclusivamente alla CypD, il team si è rivolto a librerie di piccole molecole codificate nel DNA, una tecnologia sviluppata oltre vent'anni fa come uno dei primi progetti nell'allora nuovo laboratorio di Liu. I ricercatori possono utilizzare le librerie, che sono piene di centinaia di migliaia di composti sintetici attaccati a codici a barre del DNA univoci, per scansionare le molecole che si legano alle proteine desiderate. Mescolando proteine CypD isolate e una raccolta di 256.000 composti unici codificati nel DNA in una provetta, il team ha identificato centinaia di composti promettenti.
La maggior parte dei composti iniziali si legava ancora dentro e intorno al sito attivo, inibendo più sottotipi di ciclofilina, quindi il team ha gradualmente apportato piccole modifiche chimiche ai loro composti per renderli unici per CypD. Una volta scoperto che il sito exo era la chiave per lo sviluppo di inibitori specifici del sottotipo, sono stati in grado di progettare una coppia di composti che inibiscono potentemente la CypD mentre influiscono minimamente sulle altre ciclofiline. Le strutture co-cristalline a raggi X della proteina CypD e degli inibitori durante lo sviluppo hanno offerto al team uno sguardo dietro le quinte della posizione precisa in cui le loro molecole si legavano.
I ricercatori hanno quindi trattato i mitocondri isolati con i loro due composti principali e hanno osservato che erano efficaci nel rallentare l'apertura dei pori mitocondriali da parte della CypD. Le immagini speculari dei loro composti, che non inibiscono la CypD, non hanno mostrato attività nei mitocondri. Per dimostrare che il loro successo non è stato un incidente isolato, hanno ripetuto di nuovo la strategia per CypE, una ciclofilina responsabile della regolazione dell'elaborazione dell'mRNA. Ancora una volta, hanno sviluppato un composto che lo ha preso di mira esclusivamente e ha lasciato le restanti 16 ciclofiline senza fasi.
Il team spera che le loro scoperte possano alla fine aiutare i biologi chimici e i produttori di farmaci a costruire farmaci mirati alla ciclofilina migliori e più specifici. Hanno persino dato un vantaggio ai futuri scienziati:poiché i composti che prendono di mira la CypD lottano per entrare da soli nelle cellule umane, il team li ha modificati aggiungendo derivati esteri che bypassano efficacemente la membrana plasmatica e si trasferiscono nei mitocondri.
"Il lavoro del nostro team alla fine ci ha permesso di superare questo problema di vecchia data:come inibire selettivamente un solo sottotipo di ciclofilina su 17?" ha detto Liu, che è anche un investigatore dell'Howard Hughes Medical Institute. "In futuro, le molecole che derivano dall'utilizzo della nostra strategia, spero, si dimostreranno utili sia per la scienza di base che potenzialmente per la terapia". + Esplora ulteriormente