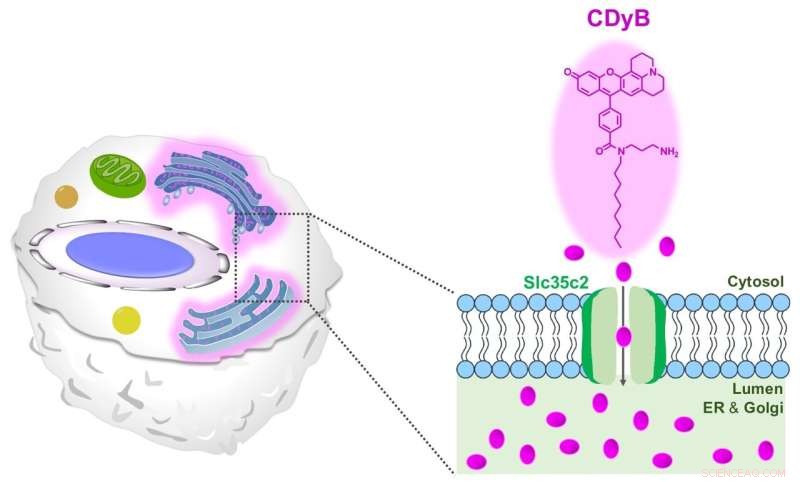
Il meccanismo di colorazione proposto di CDyB. Credito:Istituto per le scienze di base
Il nostro sistema immunitario è essenziale per la nostra sopravvivenza, poiché i nostri corpi sono costantemente esposti a batteri, virus, parassiti e altri agenti patogeni. Senza un sistema immunitario, perderemmo rapidamente la guerra contro questi agenti patogeni e soccomberemmo a questi invasori esterni. Il sistema immunitario è costituito da miliardi di singoli globuli bianchi che circolano nel nostro flusso sanguigno e si muovono nei nostri tessuti, controllando la ricerca di segni di infezione o danni ai tessuti. Le difese del corpo sono costituite da numerosi diversi tipi di globuli bianchi che includono linfociti, monociti e granulociti. I linfociti sono a loro volta ulteriormente suddivisi in cellule T, cellule B e cellule NK.
L'identificazione di ciascun tipo cellulare è essenziale per comprendere i loro ruoli specifici e condurre ricerche nel campo dell'immunologia. I linfociti T e B sono due delle principali cellule immunitarie adattative nei sistemi di difesa del nostro corpo. Tuttavia, le dimensioni e la forma simili delle cellule rendono difficile distinguerle. Attualmente, la distinzione tra diversi tipi cellulari viene effettuata colorando le cellule utilizzando anticorpi fluorescenti che si legano a diversi gruppi di recettori di differenziazione (CD) sulla superficie cellulare.
Ora, un team guidato dal professor Chang Young-Tae presso il Center for Self-assembly and Complexity all'interno dell'Institute for Basic Science di Pohang, in Corea del Sud, ha sviluppato con successo una sonda per piccole molecole CDyB (che sta per Compound of Designation yellow for B cell ) che possono realizzare la distinzione dei linfociti B vivi dai linfociti T. CDyB è stato scoperto utilizzando uno screening imparziale della libreria di fluorescenza chiamato Diversity Oriented Fluorescence Library o DOFL. Utilizzando questo processo, i ricercatori sono stati in grado di selezionare migliaia di molecole diverse per la loro specificità rispetto a un tipo di cellula immunitaria rispetto a un altro. Quando applicata a una miscela di cellule T e B, questa nuova sonda è risultata avere un'elevata selettività verso le cellule B.
CDyB è un nuovo tipo di sonda che non richiede anticorpi specifici per CD per distinguere i diversi tipi cellulari. Piuttosto, è stato scoperto che è in grado di entrare nella cellula stessa e colorare il reticolo endoplasmatico (ER) e l'apparato del Golgi, che sono organelli prominenti all'interno delle cellule responsabili del trasporto di materiali all'interno delle cellule. Si pensa che ciò sia possibile grazie alla capacità della molecola di passare facilmente attraverso le membrane cellulari.
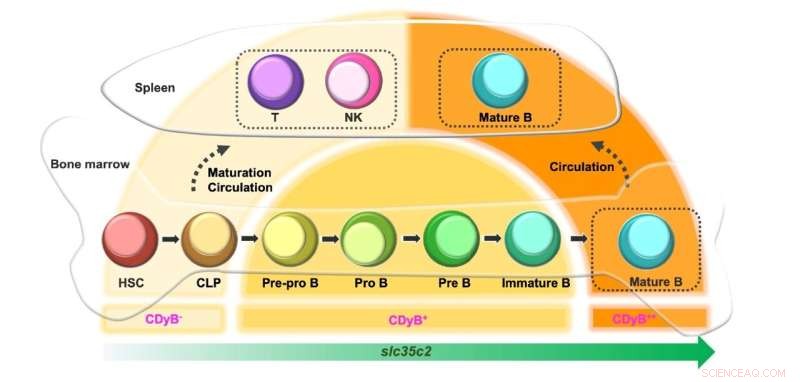
Schema dell'intensità della fluorescenza CDyB a seconda dello sviluppo delle cellule B. Credito:Istituto per le scienze di base
Dopo aver realizzato che CDyB è localizzato all'interno degli organelli ER / Golgi, i ricercatori hanno ipotizzato che il meccanismo della selettività delle cellule B si basi sul gating. In altre parole, alcune molecole trasportatrici devono essere responsabili dell'assorbimento e dell'accumulo del CDyB all'interno degli organelli di alcune cellule, ma non di altre. Quindi hanno coniato il nuovo termine, distinzione di cellule vive orientata al gating (GOLD) per descrivere questo meccanismo recentemente scoperto per distinguere diversi tipi di cellule.
Successivamente, i ricercatori hanno cercato di scoprire perché CDyB colora solo gli organelli delle cellule B, ma non le cellule T. I ricercatori hanno ulteriormente esplorato il meccanismo della nuova sonda utilizzando una libreria basata su SLC-CRISPR, che è una piattaforma che offre un'elevata possibilità di delucidazione sistematica del bersaglio di gating. Impiegando SLC-CRISPRa e SLC-CRISPRi, i ricercatori hanno scoperto che SLC35C2 era il trasportatore specifico per CDyB, che consente il trasporto della molecola all'interno degli organelli. Il trasportatore target è stato ulteriormente convalidato dall'analisi dell'espressione genica. I ricercatori hanno eseguito ulteriori esperimenti di knockout e hanno dimostrato che l'eliminazione del trasportatore rimuoveva la capacità della molecola di essere interiorizzata dall'ER / Golgi delle cellule bersaglio, dimostrando il ruolo di SlC35C2 per la selettività delle cellule B.
È interessante notare che i ricercatori hanno osservato che il segnale CDyB era più forte nei linfociti B maturi rispetto ai linfociti B immaturi. Ciò è molto probabilmente dovuto all'espressione di SLC35C che aumenta in base alla maturità dei linfociti B. Le cellule progenitrici come le cellule staminali ematopoietiche (HSC) e il progenitore linfoide comune (CLP) esprimono un basso livello di SLC35C2 e sono quindi minimamente colorate da CDyB. Quando si differenziano in cellule T e NK, l'espressione di SLC35C2 rimane bassa, producendo quindi una debole fluorescenza CDyB. Se le cellule si differenziano in lignaggi di cellule B, l'espressione di SLC35C2 aumenta durante il percorso di maturazione. I progenitori delle cellule B parzialmente differenziati (Pre-Pro B, Pro B, Pre B) mostrano una fluorescenza CDyB moderata e le cellule B completamente maturate mostrano il livello più alto di fluorescenza CDyB.
In particolare, il team del professor Chang ha precedentemente sbloccato un'altra sonda selettiva per le cellule B chiamata CDgB (Compound of Designation green for B Cells) l'anno scorso. A differenza di CDyB, distingue i linfociti B rispetto ai linfociti T utilizzando il meccanismo LOLD (Lipid-Oriented Live-cell Distinction). LOLD utilizza la piccola differenza nei componenti della membrana, come la lunghezza della catena di carbonio e il contenuto di colesterolo, e la flessibilità per la discriminazione cellulare. Mentre CDyB ha mostrato una fluorescenza più forte nelle cellule B mature, CDgB ha mostrato la colorazione più brillante nelle cellule B immature a causa della loro struttura della membrana più morbida. Si spera che l'utilizzo di entrambe queste molecole con meccanismi insieme possa essere un modo efficace per distinguere i diversi tipi cellulari nelle cellule del sangue.
Questo studio arricchisce la cassetta degli attrezzi della sonda molecolare e la comprensione molecolare per la distinzione delle cellule B vive e apre la possibilità dell'analisi cellulare multidimensionale basata sul meccanismo ortogonale con nuove conoscenze. Questo lavoro è stato pubblicato nella Angewandte Chemie International Edition il 5 luglio. + Esplora ulteriormente