Astratto grafico. Credito:Biologia chimica della natura (2022). DOI:10.1038/s41589-022-01049-9
In un nuovo studio pubblicato su Nature Chemical Biology , i ricercatori del Children's Hospital di Filadelfia (CHOP) hanno rivelato la meccanica molecolare di una molecola sulla superficie cellulare che è un potenziale bersaglio dell'immunoterapia. Utilizzando tecniche sofisticate, inclusa la spettroscopia di risonanza magnetica nucleare (NMR), i ricercatori hanno dimostrato l'importanza delle cosiddette molecole chaperone nella stabilizzazione di questo bersaglio, noto come proteina 1 correlata a MHC-I (MR1).
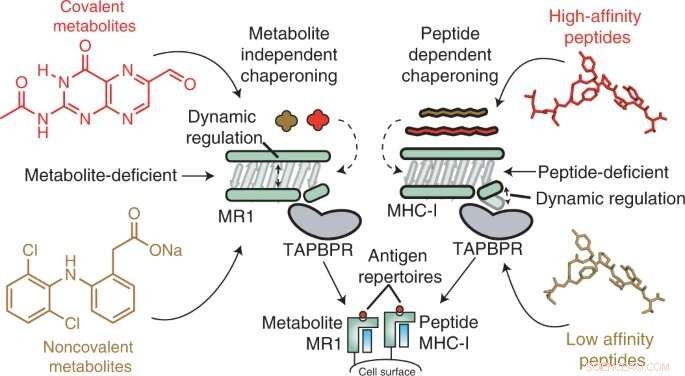
Le molecole del complesso maggiore di istocompatibilità di classe I (MHC-I) vivono sulla superficie di quasi tutte le cellule e presentano antigeni peptidici al sistema immunitario, in modo che le cellule immunitarie possano rilevare quando è presente un antigene estraneo, come quelli di batteri, virus o anche in via di sviluppo di tumori. In un processo simile, la proteina 1 correlata a MHC-I (MR1) presenta metaboliti più piccoli sulla sua superficie per la sorveglianza da parte delle cellule immunitarie specifiche dell'MR1, in particolare le cellule T invarianti associate alla mucosa (MAIT).
MR1 è noto per essere importante per il riconoscimento delle infezioni microbiche, l'identificazione delle cellule cancerose rispetto a quelle sane e la regolazione delle malattie autoimmuni. Studi recenti suggeriscono anche che MR1 può visualizzare una gamma molto più ampia di molecole, inclusi i metaboliti specifici del cancro, che potrebbero fungere da sensori interni per la malattia. Inoltre, MR1 non varia nella popolazione umana, il che lo rende un potenziale bersaglio promettente per l'immunoterapia. Tuttavia, prima di questo studio, la meccanica molecolare di MR1 era sconosciuta, in particolare il ruolo delle molecole chaperone nel riconoscere e stabilizzare le molecole MR1.
Utilizzando tecniche in vitro e in cellule, i ricercatori hanno scoperto che MR1 funziona in modo diverso rispetto a MHC-I, in particolare quando si tratta di carico molecolare e affinità per gli chaperon molecolari Tapasin e TAPBPR. Mentre MHC-1 ha dimostrato un'elevata affinità per gli accompagnatori molecolari quando era vuoto ma un'affinità bassa quando era caricato con antigeni di presentazione, MR1 ha interagito a livelli altrettanto bassi con TAPBPR indipendentemente dal fatto che fosse caricato con metaboliti o meno. Nonostante la breve durata del complesso, i ricercatori hanno utilizzato l'NMR per determinare con successo la sua struttura 3D in un ambiente acquoso fisiologicamente rilevante. È interessante notare che queste interazioni a bassa affinità hanno comunque consentito agli accompagnatori di catalizzare il caricamento e lo scambio di molecole di metaboliti direttamente sulla superficie di MR1.
"I nostri risultati forniscono una base per l'utilizzo di chaperoni molecolari per stabilizzare le molecole MR1 e per consentire il caricamento e la presentazione di antigeni direttamente sulla superficie cellulare", ha affermato Nikolaos G. Sgourakis, Ph.D., Professore Associato presso il Center for Computational and Genomic Medicine al Children's Hospital di Philadelphia e autore senior dello studio. "La ricerca futura dovrebbe esaminare le librerie di metaboliti per vedere quali mostrano un'elevata affinità per il legame con MR1. I ricercatori possono quindi considerare modi per aumentare l'espressione della superficie di MR1, potenzialmente promuovendo interazioni MR1/chaperone più stabili attraverso diversi approcci, come l'uso di piccole molecole ." + Esplora ulteriormente