In uno studio pubblicato in Proceedings of the National Academy of Sciences , I ricercatori di Umeå descrivono una molecola simile a un prodotto naturale, la tantalosina, che inibisce l'interazione tra due proteine in complessi che rimodellano le membrane all'interno della cellula.
I risultati portano a una comprensione più approfondita del funzionamento del rimodellamento della membrana nelle cellule umane e allo sviluppo futuro di nuovi farmaci.
"Il nostro studio è un buon caso per utilizzare piccole molecole come preziosi strumenti chimici per comprendere meccanismi biologici complessi. Sono felice di coordinare una fantastica collaborazione con colleghi di Umeå, Stoccolma e Germania", afferma Yaowen Wu, professore presso il Dipartimento di Chimica dell'Università di Stoccolma. Università di Umeå.
Le membrane cellulari sono costituite da lipidi e proteine e svolgono funzioni di barriera per le cellule e gli organelli intracellulari. Le membrane cellulari sono strutture fluide a mosaico altamente dinamiche che subiscono un costante rimodellamento. Il complesso di smistamento endosomiale richiesto per il trasporto (ESCRT) ha il compito di rimodellare le membrane all'interno della cellula. Il meccanismo ESCRT si assembla nel punto della cellula in cui le membrane necessitano di deformazione e quindi forma polimeri proteici elicoidali che possono contrarsi e staccare le membrane cellulari.
In precedenza, il professor Yaowen Wu e il suo gruppo, in collaborazione con il laboratorio del professor Herbert Waldmann presso il Max Planck Institute di Dortmund in Germania, avevano identificato una molecola chimica, la tantalosina, che induce un fenotipo come l'autofagia, un processo di auto-mangiamento nella cellula.
La tantalosina è una molecola sintetica ispirata agli alcaloidi della pianta medicinale China. Il team ha osservato un fenomeno molto interessante nella cellula trattata con tantalosina e ha studiato ulteriormente il meccanismo molecolare con cui la tantalosina agisce nella cellula. In collaborazione con la struttura principale di proteomica chimica presso SciLifeLab presso l'Istituto Karolinska, il team ha esaminato i potenziali bersagli cellulari della tantalosina.
"Con nostra sorpresa, abbiamo scoperto che nessuna delle proteine correlate all'autofagia era nell'elenco dei potenziali bersagli. Tuttavia, la proteina IST1 nei complessi ESCRT è stata identificata e convalidata come bersaglio cellulare della tantalosina. Eravamo entusiasti di lavorare per decifrare questo inaspettato connessione tra i complessi ESCRT e l'autofagia", afferma la prima autrice Anastasia Knyazeva, che ha recentemente completato il suo dottorato presso il Dipartimento di Chimica dell'Università di Umeå.
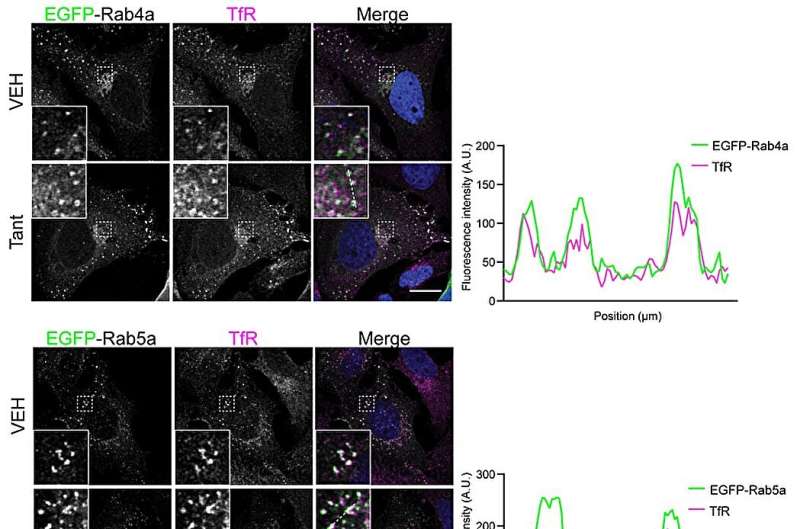
I ricercatori hanno caratterizzato il meccanismo utilizzando una serie di metodi biochimici e biologici cellulari. Quando hanno studiato l'interazione proteina-proteina in soluzione, hanno scoperto che la tantalosina interrompe completamente l'interazione tra IST1 e il suo partner di legame CHMP1B.
"Abbiamo poi esaminato più da vicino queste due proteine utilizzando un microscopio elettronico a trasmissione in collaborazione con Kasturika Shankar, una dottoranda del laboratorio di Lars-Anders Carlson presso l'Università di Umeå. Curiosamente, la tantalosina interrompe la formazione dei filamenti ordinati IST1-CHMP1B ," spiega Shuang Li, co-primo autore dell'articolo e ricercatore post-dottorato presso il Dipartimento di Chimica dell'Università di Umeå.
Inoltre, i ricercatori hanno esaminato l'interno della cellula e hanno scoperto che la tantalosina interrompe rapidamente il riciclo dei recettori presenti sulla superficie cellulare. Questa proprietà potrebbe essere potenzialmente utile per il trattamento di alcuni tipi di cancro causati dai recettori sulla superficie cellulare.
In questo studio, i ricercatori hanno scoperto che la proteina LC3, che di solito è un segno distintivo dell’autofagia, è collegata alle membrane endosomali durante il trattamento con tantalosina. È interessante notare che la degradazione autofagica canonica non è stata osservata. Invece, hanno scoperto che il processo segue un percorso autofagico non canonico.
"Crediamo che la tantalosina possa essere una molecola unica che facilita la comprensione di nuove funzioni di coniugazione non canonica di LC3 alle membrane endosomali. Ci auguriamo che ulteriori studi rivelino il ruolo della coniugazione della membrana LC3 e delle proteine associate nei processi di deformazione della membrana", afferma Knyazeva. .
Ulteriori informazioni: Anastasia Knyazeva et al, Un inibitore chimico dell'interazione IST1-CHMP1B compromette il riciclo endosomiale e induce la lipidazione non canonica di LC3, Atti dell'Accademia nazionale delle scienze (2024). DOI:10.1073/pnas.2317680121
Informazioni sul giornale: Atti dell'Accademia Nazionale delle Scienze
Fornito dall'Università di Umea