Dal Parkinson e dall'Alzheimer all'aritmia cardiaca, gli amiloidi sono collegati a numerose malattie. Questi aggregati di proteine si formano nel corpo quando una proteina perde la sua struttura normale e si ripiega o muta. E poiché molte di queste proteine sono grandi e complicate, il modo in cui si verificano e si aggregano alcune di queste mutazioni rimane un mistero, così come la creazione di trattamenti efficaci.
Una nuova ricerca sul glaucoma condotta dai chimici della Georgia Tech e da un'ex studentessa potrebbe aiutare a cambiare la situazione.
"È stato fatto molto lavoro per capire come le proteine ripiegate più piccole formano aggregati amiloidi, ma questo studio ci aiuta a comprendere il percorso di aggregazione di un sistema più grande e complesso", afferma la co-autrice Emily Saccuzzo. Questo lavoro potrebbe un giorno aiutare gli scienziati a scoprire nuove modalità di trattamento, non solo per il glaucoma, ma anche per altre malattie causate dall'aggregazione proteica.
Saccuzzo ha avviato il progetto nel 2018 come studente laureato presso il Lieberman Lab presso la Scuola di Chimica e Biochimica della Georgia Tech e ora è un ricercatore associato post-dottorato presso i Pacific Northwest National Labs.
"Emily era una studentessa estiva prima di immatricolarsi e ha stabilito la fattibilità iniziale di fare questi esperimenti", afferma Raquel Lieberman, professore e titolare della cattedra di Chimica Sepicc Pfeil presso la Georgia Tech. "Sono immensamente orgoglioso di lei."
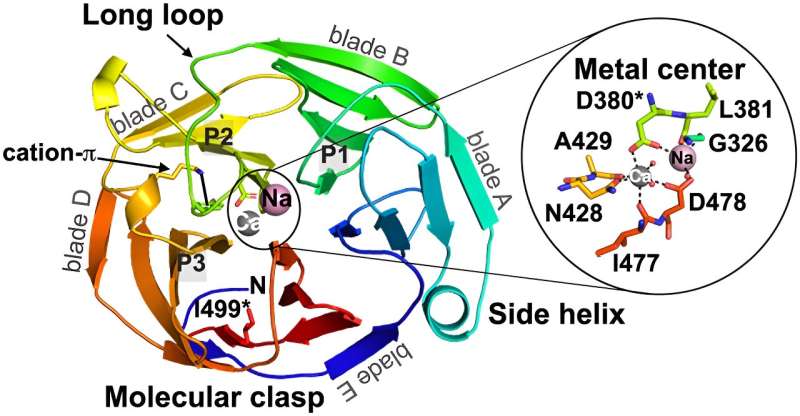
Le recenti scoperte del loro gruppo di ricerca sono presentate in un articolo, "Competizione tra inside-out unfolding e patogenic aggregation in an amyloid-forming β-propeller", pubblicato sulla rivista Nature Communications .
Lieberman e Saccuzzo hanno riunito ricercatori provenienti da tutto l'Istituto e non solo per collaborare allo studio.
"Si è trattato di un progetto molto multidisciplinare ed è sempre molto soddisfacente", afferma Lieberman. "Penso che quando riunisci più persone al tavolo, puoi rispondere a domande difficili e fare più di quanto potresti fare da solo."
Mentre molti studi si sono concentrati su proteine più piccole, chiamate proteine modello, che hanno stabilito “regole” e modelli noti per la formazione dell’amiloide (un tipo specializzato di aggregazione proteica), la proteina che contribuisce al glaucoma è più grande e più complessa. Questo tipo di proteina più grande e complicata è relativamente non studiata.
"Sapevamo da tempo che le mutazioni nella miocilina possono causare il ripiegamento errato e l'aggregazione della proteina, che a sua volta porta al glaucoma", afferma Saccuzzo. "Ciò che non sapevamo, tuttavia, era l'esatto meccanismo attraverso il quale questa proteina si ripiega e si aggrega in modo errato.
"L'obiettivo di questo studio era determinare in che modo i mutanti della malattia vengono ripiegati in modo errato, nella speranza che ciò ci possa fornire informazioni sui primi passi nel percorso di aggregazione", aggiunge.
Situata all'interfaccia tra il bianco dell'occhio e l'iride colorata, la proteina forma un minuscolo anello tutto intorno all'occhio.
"Ogni volta che sbatti le palpebre, allunghi quel muscolo. Ogni volta che il vento soffia molto forte o ti entra qualcosa negli occhi. Ogni volta che ti strofini gli occhi, potresti influenzare questa proteina, anche quando non causa malattie", Lieberman dice.
Tuttavia, gli scienziati non sono sicuri di cosa faccia la proteina. "Sappiamo cosa fa solo quando causa problemi", come il glaucoma, spiega. "Non sappiamo quale sia la sua reale funzione biologica."
Lieberman inizialmente era attratta dall'idea di studiare la proteina perché si chiedeva se la ricerca condotta sulle proteine modello potesse essere applicabile alla proteina che causa il glaucoma.
"I primi studi hanno dimostrato che probabilmente era simile a queste proteine modello che formano l'amiloide", afferma Lieberman. "Volevo approfondire questo aspetto perché, se fossimo riusciti a dimostrare che ciò era vero, avremmo potuto attingere alle straordinarie risorse e alla ricerca condotta su sistemi modello per aiutarci a combattere la malattia."
"Questa era una delle più grandi proteine che formano amiloide caratterizzate fino ad oggi", dice Saccuzzo, e mentre il team sperava di trovare somiglianze con le proteine modello, la proteina più grande associata al glaucoma ha mostrato una maggiore complessità.
"Penso che una delle osservazioni più sorprendenti che abbiamo fatto sia che la proteina stessa non è in equilibrio per circa 90 giorni dopo la sua produzione", aggiunge Lieberman. "Uno dei principi della chimica delle proteine è che le sequenze di amminoacidi adottano una struttura unica e che tutte le informazioni necessarie per ripiegare la proteina nella sua struttura 3D sono contenute in quella sequenza di amminoacidi."
Qui, la proteina tremolava leggermente, il che significa che non era in equilibrio. "C'è molto di più nel sistema di quanto chiunque avrebbe potuto immaginare", spiega Lieberman. "Partiamo dal presupposto che la forma controlli alcune proprietà, ma questo è un altro mistero di questa proteina."
Poiché la proteina è così complicata e non è in equilibrio, "c'è un lungo elenco di cose che non possiamo prevedere", afferma Lieberman, aggiungendo che ciò rende difficili le previsioni computerizzate, insieme ad alcuni esperimenti. "È stato un momento in cui abbiamo pensato:wow, ecco questo nuovo sistema a cui le persone dovrebbero pensare. Le regole potrebbero essere perfezionate per aiutarci a capire meglio cosa sta succedendo."
Anche se saranno necessarie ulteriori ricerche per determinare il modo migliore per trattare il glaucoma, lo studio fornisce una base fondamentale per studi futuri. "Ciò che non mi è chiaro in questo momento è se saremo in grado di trovare un farmaco per tutte le persone che presentano mutazioni o se avremo bisogno di un farmaco specifico per ogni tipo di mutazione che incontreremo", afferma Lieberman.
Sebbene la ricerca non dimostri che un trattamento potrebbe non essere efficace per tutti, "dimostra certamente che in questo sistema c'è molto di più di quanto ci aspettassimo".
"Capire come appaiono i mutanti della malattia a livello molecolare potrebbe aiutare ad aprire la strada a terapie e strumenti diagnostici per il glaucoma strutturalmente specifici", aggiunge Saccuzzo.
Lieberman e Saccuzzo sottolineano inoltre che il lavoro svolto per comprendere la proteina responsabile del glaucoma può essere applicato anche ad altre proteine di grandi dimensioni.
"Alla fine, il numero delle proteine non modello è maggiore di quello delle proteine modello", afferma Lieberman.
"Ci sono molti più sistemi là fuori, e sospetto che ci siano molte più proteine che possono aggregarsi e contribuire alla malattia o all'invecchiamento che devono ancora essere esplorate. Penso che questa ricerca mostri il valore di utilizzare molti approcci diversi per sondare un sistema complicato per saperne di più."
Ulteriori informazioni: Emily G. Saccuzzo et al, Competizione tra dispiegamento interno-esterno e aggregazione patogena in un'elica β che forma amiloide, Nature Communications (2024). DOI:10.1038/s41467-023-44479-2
Informazioni sul giornale: Comunicazioni sulla natura
Fornito dal Georgia Institute of Technology