Una reazione chimica chiave, in cui il movimento dei protoni tra la superficie di un elettrodo e un elettrolita genera una corrente elettrica, è un passaggio fondamentale in molte tecnologie energetiche, comprese le celle a combustibile e gli elettrolizzatori utilizzati per produrre gas idrogeno.
Per la prima volta, i chimici del MIT hanno mappato in dettaglio come questi trasferimenti di elettroni accoppiati a protoni avvengono sulla superficie di un elettrodo. I loro risultati potrebbero aiutare i ricercatori a progettare celle a combustibile, batterie o altre tecnologie energetiche più efficienti.
Il documento di ricerca è pubblicato sulla rivista Nature Chemistry .
"Il nostro progresso in questo articolo è stato lo studio e la comprensione della natura di come questi elettroni e protoni si accoppiano in un sito superficiale, che è rilevante per le reazioni catalitiche che sono importanti nel contesto dei dispositivi di conversione dell'energia o delle reazioni catalitiche", afferma Yogesh Surendranath, un professore di chimica e ingegneria chimica al MIT e autore senior dello studio.
Tra le loro scoperte, i ricercatori sono stati in grado di tracciare esattamente come i cambiamenti nel pH della soluzione elettrolitica che circonda un elettrodo influenzano la velocità del movimento dei protoni e il flusso di elettroni all'interno dell'elettrodo.
Lo studente laureato del MIT Noah Lewis è l'autore principale dell'articolo. Ryan Bisbey, ex postdoc del MIT; Karl Westendorff, uno studente laureato del MIT; e Alexander Soudackov, ricercatore presso l'Università di Yale, sono anche autori dell'articolo.
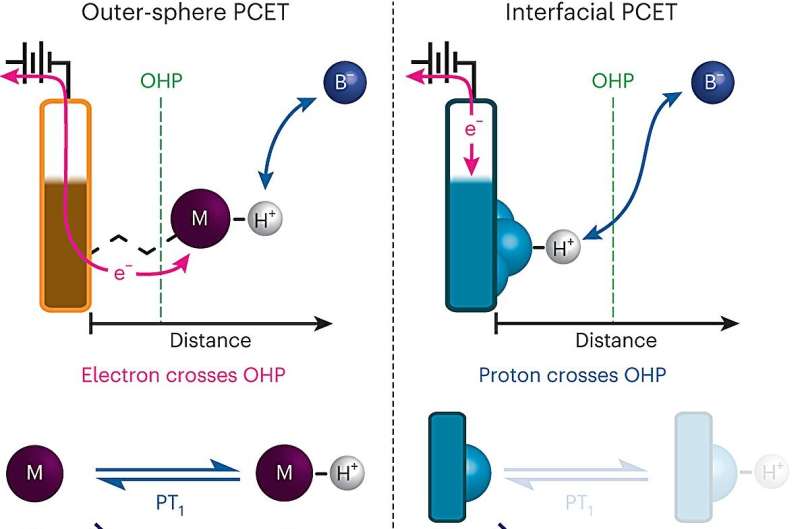
Il trasferimento di elettroni accoppiati a protoni avviene quando una molecola, spesso acqua o un acido, trasferisce un protone a un'altra molecola o alla superficie di un elettrodo, che stimola anche l'accettore di protoni ad assorbire un elettrone. Questo tipo di reazione è stata sfruttata per molte applicazioni energetiche.
"Queste reazioni di trasferimento di elettroni accoppiati a protoni sono onnipresenti. Sono spesso passaggi chiave nei meccanismi catalitici e sono particolarmente importanti per i processi di conversione dell'energia come la generazione di idrogeno o la catalisi delle celle a combustibile", afferma Surendranath.
In un elettrolizzatore che genera idrogeno, questo approccio viene utilizzato per rimuovere protoni dall'acqua e aggiungere elettroni ai protoni per formare gas idrogeno. In una cella a combustibile, l'elettricità viene generata quando protoni ed elettroni vengono rimossi dal gas idrogeno e aggiunti all'ossigeno per formare acqua.
Il trasferimento di elettroni accoppiati a protoni è comune in molti altri tipi di reazioni chimiche; ad esempio, la riduzione dell’anidride carbonica (la conversione dell’anidride carbonica in combustibili chimici mediante l’aggiunta di elettroni e protoni). Gli scienziati hanno imparato molto su come avvengono queste reazioni quando gli accettori di protoni sono molecole, perché possono controllare con precisione la struttura di ciascuna molecola e osservare come elettroni e protoni passano tra di loro.
Tuttavia, quando il trasferimento di elettroni accoppiati a protoni avviene sulla superficie di un elettrodo, il processo è molto più difficile da studiare perché le superfici degli elettrodi sono solitamente molto eterogenee, con molti siti diversi a cui un protone potrebbe potenzialmente legarsi.
Per superare questo ostacolo, il team del MIT ha sviluppato un modo per progettare le superfici degli elettrodi che offre loro un controllo molto più preciso sulla composizione della superficie dell’elettrodo. I loro elettrodi sono costituiti da fogli di grafene con composti organici contenenti anelli attaccati alla superficie. Alla fine di ciascuna di queste molecole organiche c'è uno ione di ossigeno caricato negativamente che può accettare protoni dalla soluzione circostante, che fa sì che un elettrone fluisca dal circuito alla superficie grafitica.
"Possiamo creare un elettrodo che non sia costituito da un'ampia diversità di siti ma sia una serie uniforme di un singolo tipo di siti molto ben definiti, ciascuno dei quali può legare un protone con la stessa affinità", afferma Surendranath. "Dato che disponiamo di questi siti molto ben definiti, ciò che ci ha permesso di fare è stato davvero svelare la cinetica di questi processi."
Usando questo sistema, i ricercatori sono stati in grado di misurare il flusso di corrente elettrica agli elettrodi, cosa che ha permesso loro di calcolare la velocità di trasferimento dei protoni allo ione ossigeno sulla superficie all'equilibrio, lo stato in cui i tassi di donazione di protoni alla superficie e il trasferimento di protoni dalla superficie alla soluzione sono uguali. Hanno scoperto che il pH della soluzione circostante ha un effetto significativo su questo tasso:i tassi più alti si sono verificati alle estremità estreme della scala del pH:pH 0, il più acido, e pH 14, il più basico.
Per spiegare questi risultati, i ricercatori hanno sviluppato un modello basato su due possibili reazioni che possono verificarsi all’elettrodo. Nella prima, gli ioni idronio (H 3 O + ), che sono in alta concentrazione in soluzioni fortemente acide, forniscono protoni agli ioni di ossigeno superficiali, generando acqua. Nella seconda, l'acqua consegna protoni agli ioni di ossigeno superficiali, generando ioni idrossido (OH - ), che sono in alta concentrazione in soluzioni fortemente basiche.
Tuttavia, la velocità a pH 0 è circa quattro volte più veloce della velocità a pH 14, in parte perché l'idronio cede protoni a una velocità più veloce dell'acqua.
I ricercatori hanno anche scoperto, con loro sorpresa, che le due reazioni hanno velocità uguali non a pH neutro 7, dove le concentrazioni di idronio e idrossido sono uguali, ma a pH 10, dove la concentrazione di ioni idrossido è 1 milione di volte quella dell'idronio. Il modello suggerisce che ciò è dovuto al fatto che la reazione diretta che coinvolge la donazione di protoni da idronio o acqua contribuisce maggiormente alla velocità complessiva rispetto alla reazione all'indietro che coinvolge la rimozione di protoni da parte di acqua o idrossido.
I modelli esistenti di come si verificano queste reazioni sulle superfici degli elettrodi presuppongono che le reazioni in avanti e all'indietro contribuiscano equamente alla velocità complessiva, quindi i nuovi risultati suggeriscono che potrebbe essere necessario riconsiderare tali modelli, dicono i ricercatori.
"Questo è il presupposto predefinito, che le reazioni dirette e inverse contribuiscono equamente alla velocità di reazione", afferma Surendranath. "La nostra scoperta è davvero illuminante perché significa che il presupposto che le persone utilizzano per analizzare qualsiasi cosa, dalla catalisi delle celle a combustibile all'evoluzione dell'idrogeno, potrebbe essere qualcosa che dobbiamo rivisitare."
I ricercatori stanno ora utilizzando la loro configurazione sperimentale per studiare come l'aggiunta di diversi tipi di ioni alla soluzione elettrolitica che circonda l'elettrodo possa accelerare o rallentare la velocità del flusso di elettroni accoppiati ai protoni.
"Con il nostro sistema, sappiamo che i nostri siti sono costanti e non si influenzano a vicenda, quindi possiamo leggere che effetto ha il cambiamento nella soluzione sulla reazione in superficie", afferma Lewis.
Ulteriori informazioni: Noah B. Lewis et al, Una struttura meccanicistica a livello molecolare per la cinetica di trasferimento di elettroni accoppiati a protoni interfacciali, Chimica naturale (2024). DOI:10.1038/s41557-023-01400-0
Informazioni sul giornale: Chimica della Natura
Fornito dal Massachusetts Institute of Technology
Questa storia è stata ripubblicata per gentile concessione di MIT News (web.mit.edu/newsoffice/), un popolare sito che copre notizie sulla ricerca, l'innovazione e l'insegnamento del MIT.