Gli anticorpi (immunoglobuline) sono proteine a forma di Y che riconoscono e neutralizzano specifici agenti patogeni. La loro capacità di colpire molecole o cellule specifiche li ha resi candidati promettenti per il futuro sviluppo di farmaci. Tuttavia, le loro catene leggere, parti dell'anticorpo che contribuiscono a riconoscere e legarsi a specifici antigeni, si ripiegano male e si aggregano, portando all'amiloidosi, una condizione che provoca complicazioni e disfunzione dei tessuti nel corpo.
Nel contesto dello sviluppo di farmaci, l’aggregazione degli anticorpi può compromettere la loro capacità di legarsi agli antigeni e diminuirne il potenziale terapeutico. Tuttavia, la mancanza di informazioni strutturali dettagliate sulla sua aggregazione è uno dei fattori che ostacolano il progresso in questo campo.
Di conseguenza, gli sforzi in corso mirano a fornire rapporti dettagliati sulle strutture aggregate e sui loro meccanismi di formazione per promuovere lo sviluppo di farmaci anticorpali.
In uno studio pubblicato su Nature Communications , un team di ricercatori giapponesi, guidato da Shun Hirota del Nara Institute of Science and Technology (NAIST), ha recentemente fornito nuove informazioni sulle strutture formate durante l'aggregazione degli anticorpi attraverso lo scambio di domini 3D (3D-DS), un processo in cui uno specifico regione di una proteina viene scambiata tra due o più molecole della stessa proteina.
Il processo 3D-DS è stato osservato in varie proteine ma non nelle catene leggere degli anticorpi fino al presente studio.
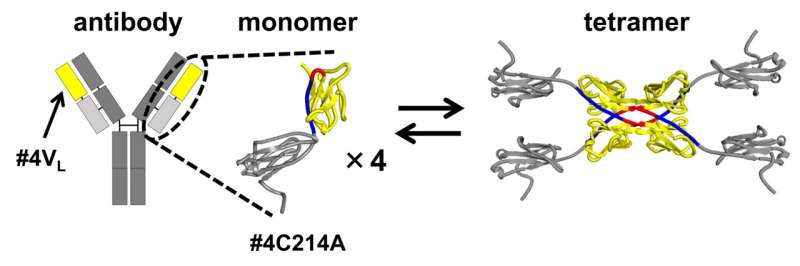
Nella loro indagine, i ricercatori hanno utilizzato una versione modificata della catena leggera dell’anticorpo. In questa forma modificata, un residuo di cisteina (Cys), che tipicamente forma un legame disolfuro con una cisteina a catena pesante, è stato sostituito con alanina (Ala). Questa alterazione ha permesso al team di isolare e studiare le strutture risultanti dal 3D-DS nel segmento dell'anticorpo che contribuisce al legame con l'antigene.
Il 3D-DS della catena leggera dell'anticorpo comporta la formazione di dimeri (strutture costituite da due subunità identiche) e tetrameri (strutture composte da due dimeri con quattro subunità identiche).
"Il nostro studio fornisce il primo rapporto sulla struttura a livello atomico del fenomeno 3D-DS nella regione variabile della catena leggera di un anticorpo", sottolinea Hirota.
La cromatografia ad esclusione dimensionale della catena leggera dell'anticorpo n. 4C214A ha rivelato che l'anticorpo esiste come singoli monomeri e tetrameri a quattro subunità. Per determinare la regione in cui si formano i tetrameri, i ricercatori hanno suddiviso la catena leggera dell'anticorpo in una regione variabile (la punta dell'anticorpo a forma di Y) e una regione costante (la parte centrale dell'anticorpo a forma di Y).
Hanno scoperto che la regione variabile #4VL può passare dallo stato monomerico a quello tetramerico.
Ulteriori analisi utilizzando la cristallografia a raggi X e simulazioni termodinamiche hanno rivelato che la formazione dei tetrameri è guidata dalle interazioni idrofobiche che si verificano tra due dimeri 3D-DS.
Rispetto ai monomeri, si è scoperto che i tetrameri hanno strutture β-sheet più rigide, che li rendono meno flessibili. La formazione del tetramero 3D-DS può aiutare a prevenire l'aggregazione proteica diminuendo la flessibilità, evitando potenzialmente la formazione di aggregati insolubili. D'altra parte, il 3D-DS può favorire l'aggregazione degli anticorpi.
Hirota conclude:"Questi risultati non solo chiariscono la struttura con scambio di domini della catena leggera dell'anticorpo, ma contribuiscono anche al controllo della qualità degli anticorpi e all'avanzamento dello sviluppo di futuri agenti e farmaci per il riconoscimento molecolare."
Ulteriori informazioni: Approfondimenti strutturali e termodinamici sulla formazione di tetrameri di catene leggere di anticorpi attraverso lo scambio di domini 3D, Comunicazioni naturali (2023). DOI:10.1038/s41467-023-43443-4
Fornito da Nara Institute of Science and Technology