Gli elementi costitutivi dei nuovi farmaci che aiutano a combattere i batteri resistenti agli antibiotici conosciuti, ad esempio, dovrebbero essere quanto più convenienti ed ecologici possibile. Gli enzimi sono ideali per questo scopo. Ad esempio, possono produrre o combinare diversi componenti di sostanze attive.
Simon Schröder ha caratterizzato nella sua tesi di master presso il gruppo di biotecnologia microbica dell'Università della Ruhr di Bochum un enzima in grado di formare nelle molecole il desiderato legame azoto-azoto. Ha anche scoperto altri enzimi che possono farlo. Il lavoro è pubblicato sulla rivista Molecular Catalysis .
I ricercatori sono in costante competizione con microrganismi dannosi che sviluppano resistenza agli antibiotici. Nella ricerca di nuove sostanze attive, si cerca tradizionalmente di isolare dalla natura i microrganismi che presentano un comportamento antibiotico. Successivamente individuano le sostanze responsabili e ne studiano la funzione. Oggi, questo processo è integrato da metodi computerizzati che consentono di progettare nuove molecole su misura che hanno effetti specifici sugli organismi e sui loro processi metabolici.
"Tuttavia, la progettazione e la produzione di tali composti artificiali sono spesso limitate dalle molecole precursori o dagli elementi costitutivi disponibili per la loro produzione", spiega Schröder. Idealmente, il loro processo di produzione dovrebbe essere economico ed ecologico, ad esempio utilizzando microrganismi o i loro enzimi catalitici. Di conseguenza è importante e interessante l'ampliamento del sistema modulare delle molecole disponibili per la produzione di nuovi farmaci.

Rendere il legame desiderato più facilmente accessibile
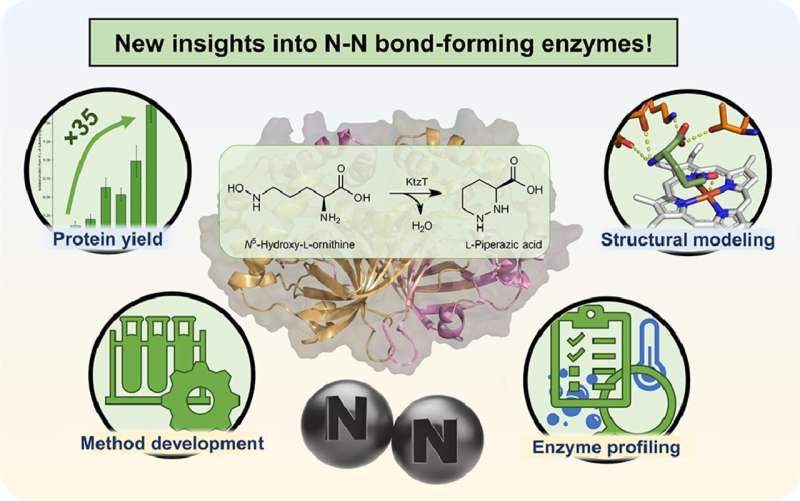
"Stiamo lavorando alla produzione di un tipo specifico di tali molecole", spiega Schröder. Nel 2017 è stato isolato un enzima in grado di formare nelle molecole il legame azoto-azoto, che raramente si trova in natura. Tuttavia si sa ancora molto poco di questo enzima dal nome sistematico "KtzT":come funziona? In quali composti può formare questo legame? È adatto a produrre molecole di rilevanza farmaceutica?
"Inizialmente siamo riusciti a migliorare la produzione e l'isolamento di questo enzima in laboratorio di un fattore 35", riferisce Schröder. "Questo ci ha permesso di caratterizzare KtzT, cioè di identificare le sue condizioni di reazione ottimali:a quale temperatura, quale valore di pH funziona meglio e quanto è stabile in un'ampia gamma di condizioni?"
Il gruppo di ricerca ha anche trovato e isolato enzimi simili a KtzT e ha dimostrato che sono anche in grado di catalizzare la reazione. "Siamo stati anche in grado di implementare una reazione in più fasi con diversi enzimi, rendendo ancora più facile l'accesso al legame azoto-azoto", afferma Schröder.
Tra l'altro ha sviluppato con metodi bioinformatici un modello strutturale dell'enzima, che consente di formulare ipotesi sul meccanismo di reazione e di modificare specificatamente l'enzima in modo che possa formare il legame azoto-azoto anche in altri composti.
Ulteriori informazioni: Simon Schröder et al, Miglioramento della formazione di legami N–N biocatalitici con la piperazato sintasi attinobatterica KtzT, Catalisi molecolare (2023). DOI:10.1016/j.mcat.2023.113733
Fornito da Ruhr-Universitaet-Bochum