L’acidificazione degli oceani, la respirazione dei mammiferi e la formazione di aerosol dipendono tutti dalla chimica che si verifica nelle interfacce aria-acqua. In una nuova ricerca, gli scienziati del Laboratorio Nazionale Lawrence Berkeley (Berkeley Lab) del Dipartimento dell'Energia hanno scoperto quale percorso avviene attraverso il biossido di carbonio (CO2 ) seguono il loro percorso dall'atmosfera all'acqua, e non è quello che si aspettavano.
Gli oceani assorbono circa il 30% di tutta la CO2 di origine antropica emissioni. Nell'acqua, la CO2 forma acido carbonico, modificando l'ambiente marino in modi dannosi per alcuni organismi marini. Nel nostro corpo, l'aria che attraversa le membrane umide che rivestono i nostri tratti nasali influenza il pH del nostro sangue.
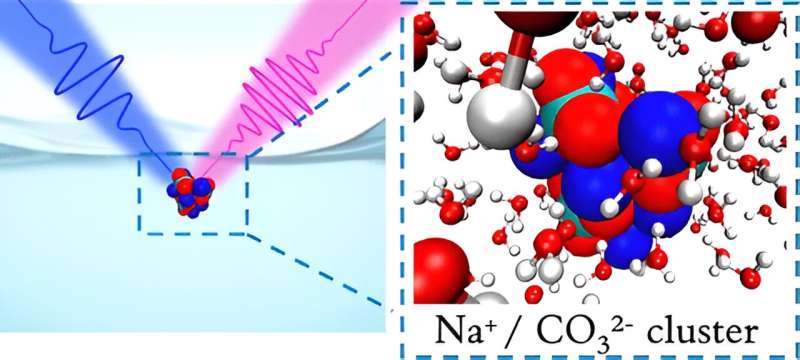
Ma il modo in cui cambia la chimica locale dipende da come la CO2 disciolta si separa in due ioni diversi con cariche diverse - carbonato a carica doppia e bicarbonato a carica singola - vicino alla superficie del liquido. I ricercatori del Berkeley Lab ora mostrano una maggiore concentrazione di carbonato nelle interfacce aria-acqua, dove si aspettavano di trovare più bicarbonato.
"Il ciclo del carbonio della Terra, così come il ciclo della respirazione dei mammiferi, prevede esplicitamente la dissoluzione della CO2 alla superficie dell'acqua e la sua trasformazione in bicarbonato e ioni carbonato. Comprendere le reazioni all'interfaccia aria-acqua illuminerà ulteriormente questi processi di vitale importanza", ha affermato Jin Qian, un ricercatore che ha contribuito alla parte teorica del lavoro riportato nel Journal of American Chemical Society . Qian è uno scienziato della divisione di scienze chimiche del Berkeley Lab.
I processi chimici che si verificano all'interfaccia liquido-aria sono spesso distinti dagli stessi che si verificano nel corrispondente liquido sfuso. La teoria classica dei libri di testo indica che il carbonato dovrebbe rimanere nella massa liquida, mentre il bicarbonato dovrebbe concentrarsi in superficie; ma una comprensione dettagliata dei percorsi dei due ioni è rimasta poco chiara. Poiché la superficie di una soluzione comprende solo una piccola frazione del suo volume totale, misurare le concentrazioni di ioni è difficile.
"Non solo il segnale è molto debole, ma deve essere separato dalla risposta molto più ampia del sistema", ha spiegato Richard Saykally, professore del Dipartimento di Chimica dell'UC Berkeley, che ha guidato il lavoro. Saykally è uno scienziato senior in pensione della Divisione di Scienze Chimiche del Berkeley Lab.
Saykally e i suoi colleghi hanno utilizzato strumenti appositamente progettati per misurare segnali chimici deboli sulle superfici liquide. La tecnica, chiamata spettroscopia di generazione di seconda armonica UV profonda (DUV-SHG), sonda direttamente gli ioni sulle interfacce del liquido.
"Ora possiamo misurare le popolazioni superficiali relative di carbonato e bicarbonato, nonché informazioni termodinamiche riguardanti la loro affinità superficiale", ha affermato Shane Devlin, ricercatore post-dottorato presso il Berkeley Lab e autore principale dello studio. Il team ha scoperto che il carbonato mostrava una tendenza molto più forte ad aderire alla superficie rispetto al bicarbonato.
Per spiegare questo comportamento altamente inaspettato, i ricercatori si sono rivolti a strumenti teorici. Tod Pascal e i suoi colleghi dell'UC San Diego hanno eseguito simulazioni al computer per capire come gli ioni carbonato e bicarbonato formano cluster, un processo che è probabilmente responsabile delle loro diverse concentrazioni in superficie e nel liquido sfuso.
Hanno scoperto che, sebbene il clustering fosse un processo favorevole per il carbonato, non lo era per il bicarbonato. Per spiegare ulteriormente le osservazioni spettroscopiche, Qian e il suo gruppo hanno eseguito simulazioni utilizzando il sistema Perlmutter presso il National Energy Research Scientific Computing Center (NERSC), una struttura per utenti DOE presso il Berkeley Lab. Hanno sviluppato un metodo che ha consentito il calcolo delle impronte spettrali del carbonato e del bicarbonato in una regione molto ampia all'interfaccia liquido-aria.
Le simulazioni hanno confermato che il carbonato mostra effettivamente una preferenza molto più forte per l’interfaccia aria-acqua. È il risultato del forte accoppiamento del carbonato con gli ioni di sodio, che ha portato a grappoli neutri di particelle che poi sono stati attratti dalla superficie.
"Questa è la prima volta che il nostro metodo computazionale è stato utilizzato in un contesto applicativo realistico, studiando l'interfaccia aria-liquido contenente circa un migliaio di atomi", afferma Qian.
Sebbene sorprendente, la misurazione potrebbe avere implicazioni di vasta portata. La superficie dell'oceano è il luogo in cui l'aria e l'acqua si mescolano, portando alla formazione di goccioline di aerosol, che svolgono un ruolo essenziale nel clima globale e nei modelli atmosferici.
Come il livello di CO2 atmosferico continua ad aumentare, il rapporto tra anioni carbonato e bicarbonato in superficie probabilmente cambierà, il che a sua volta influenzerà la chimica delle goccioline di aerosol marino. Comprendere il potenziale impatto dell'aumento delle concentrazioni di carbonato negli aerosol è importante per gli scienziati che lavorano per prevedere il cambiamento climatico.
Inoltre, il bicarbonato è uno ione relativamente delicato e può fungere da tampone fisiologico che aiuta il sangue e i tessuti a mantenere la chimica e la funzione metabolica adeguate. Al contrario, il carbonato è semplicemente troppo forte per fungere da tampone. Comprendere come questi equilibri si spostano potrebbe essere importante per una descrizione approfondita della respirazione nei mammiferi.
"Il comportamento interfacciale di queste specie e processi ha quindi un impatto diretto sia sui cicli geofisici che biologici. I risultati di questo studio motiveranno gli sforzi futuri volti ad accertare le conseguenze per l'ecologia marina", ha affermato Saykally.
Ulteriori informazioni: Shane W. Devlin et al, Agglomeration Drives the Reverse Fractionation of Aqueous Carbonate and Bicarbonate at the Air-Water Interface, Journal of the American Chemical Society (2023). DOI:10.1021/jacs.3c05093
Informazioni sul giornale: Giornale dell'American Chemical Society
Fornito dal Lawrence Berkeley National Laboratory