Ogni modello successivo per anatomia e costruzione atomica era basato sul precedente. Filosofi, teorici, fisici e scienziati hanno progressivamente sviluppato il paradigma atomico nel corso di molti secoli. Numerosi modelli ipotetici sono stati proposti, modificati e infine respinti o accettati. Molti scienziati e pensatori hanno fatto scoperte e condotto esperimenti per arrivare al modello atomico attualmente accettato. Lo sviluppo della matematica e della tecnologia specializzata ha contribuito notevolmente alla comprensione contemporanea della natura degli atomi.
Primi modelli sferici
Poiché gli atomi sono troppo piccoli per essere visti, i primi modelli teorici erano costruzioni intellettuali basate sul metodi logici di ragionamento induttivo e deduttivo. Il filosofo greco classico Democrito fu il primo a proporre l'esistenza di atomi nel 400 a.C. Ha ragionato che la materia non può essere divisa indefinitamente e deve consistere in particelle rotonde indivisibili chiamate atomi. Nel 1800, John Dalton arrivò alla stessa visione dell'atomismo usando il metodo sperimentale per studiare gas e composti. La sua teoria era chiamata modello a sfera solida, o biliardo,
Plum Pudding Model
Nel 1904 il fisico britannico J.J. Thompson ha postulato il budino di prugne, o panino all'uvetta, modello di atomismo. Si basava sulla conoscenza delle particelle subatomiche scoperte di recente di carica negativa chiamate elettroni. Gli esperimenti di Thompson con i tubi a raggi catodici lo hanno spinto a teorizzare l'esistenza di minuscole particelle all'interno degli atomi che erano parti fondamentali di tutti gli atomi. Il suo modello prevedeva che gli elettroni negativi, o prugne, sospesi all'interno di una struttura caricata positivamente, o il budino.
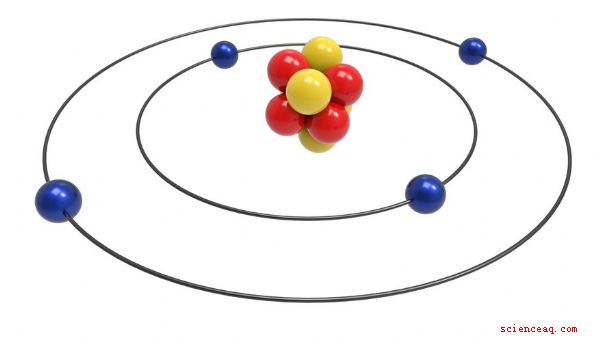
Due modelli di orbite planetarie
Dal 1910 al 1911, Ernest Rutherford propose il modello planetario, o nucleare, di l'atomo. Credeva che gli atomi fossero composti principalmente da spazio vuoto, con un nucleo denso. I suoi esperimenti riguardavano il lancio di particelle alfa su lamina d'oro. Ha concluso che il nucleo positivo contiene la maggior parte della massa dell'atomo. Con il suo modello di orbita, Niels Bohr perfezionò l'idea dell'atomo come un piccolo sistema solare nel 1913. Il modello di Bohr aveva elettroni che orbitavano attorno al nucleo in strati simili a conchiglie.
Modello di nuvola di elettroni
Louis de Broglie e Erwin Schrodinger ha sviluppato il modello di nuvola di elettroni, o meccanica quantistica. Hanno basato il modello sulle scoperte del ramo della fisica quantistica della fisica. Invece di elettroni in orbite fisse, il modello di nuvola ha le orbite definite da una distribuzione di probabilità attorno al nucleo. A seconda della loro osservazione e misurazione, gli elettroni potrebbero trovarsi in molti luoghi diversi, a volte contemporaneamente.