Sotto forma di brina o di cubetti di ghiaccio lisci e trasparenti, il ghiaccio aderisce spontaneamente e anche in modo abbastanza forte a molte superfici solide. Tuttavia, come può testimoniare qualsiasi persona sbadata che è scivolata su un marciapiede invernale, il ghiaccio può anche essere molto scivoloso. In effetti, il ghiaccio può essere sia appiccicoso che scivoloso.
Questa versatilità ha a lungo sconcertato gli scienziati. Per cominciare, sono più di 150 anni che tentano di svelare il segreto dietro la scivolosità del ghiaccio. Tra loro ci sono stati fisici famosi come Lord Kelvin e Michael Faraday. Quest'ultimo, meglio conosciuto per i suoi lavori sull'elettromagnetismo, fu il primo a prevedere la presenza di un sottile strato di acqua liquida che ricopriva il ghiaccio, anche ben al di sotto di 0°C. A quel tempo, pensò che il contatto di un oggetto solido contro lo strato superficiale lo spingesse ad agire come un lubrificante, riducendo notevolmente l’attrito sul ghiaccio. L'esistenza di questo strato liquido fu confermata da esperimenti più di un secolo dopo.
Per rispondere alla domanda "Perché il ghiaccio è scivoloso?" dobbiamo prima capire come si è formato questo sottile strato di acqua liquida sulla superficie ghiacciata.
Poiché l'acqua è più densa nella sua fase liquida che nello stato ghiacciato, per molto tempo si è pensato che lo scioglimento della superficie del ghiaccio fosse legato a un eccesso di pressione, ad esempio dovuto al peso del pattinatore sulla piccola superficie che giace sotto di lei o i suoi pattini. Comprimendo ulteriormente il ghiaccio, il pattinatore ne causerebbe lo scioglimento, rendendolo liquido e scivoloso.
Altri credono che il calore venga rilasciato per attrito mentre l'oggetto si muove sul ghiaccio, provocando lo scioglimento della superficie. Proprio come quando strofini le mani per scaldarle, quando strofini un solido contro un altro, si riscaldano.
Tuttavia, questi due meccanismi non spiegano perché il ghiaccio rimane scivoloso sotto i -20°C. A tali temperature, sarebbe necessaria una pressione considerevole, circa 500 volte quella esercitata da un pattino da ghiaccio, per provocarne lo scioglimento.
Negli anni '60, più di un secolo dopo Faraday, J.W. Telford e J.S. Turner ha tirato lentamente un filo attraverso il ghiaccio "freddo" (sotto i -20°C) per rivelare che rimaneva scivoloso fino a -35°C, momento in cui il calore rilasciato dall'attrito non era più sufficiente a sciogliere il ghiaccio.
Solo circa un secolo dopo l'intuizione di Faraday siamo riusciti a dimostrare indirettamente questo strato liquido, misurando le proprietà della superficie del ghiaccio e non del volume, in questo caso le sue proprietà di assorbimento dei vapori di idrocarburi, del tutto paragonabili a quelle del ghiaccio. acqua liquida!
Le tecniche che coinvolgono la diffusione di protoni o di raggi X, solitamente utilizzate per studiare la struttura dei cristalli, hanno permesso di stimare lo spessore tra uno e diverse centinaia di nanometri. Alcuni studi hanno addirittura suggerito che questo spessore diverga quando la temperatura si avvicina a 0°C.
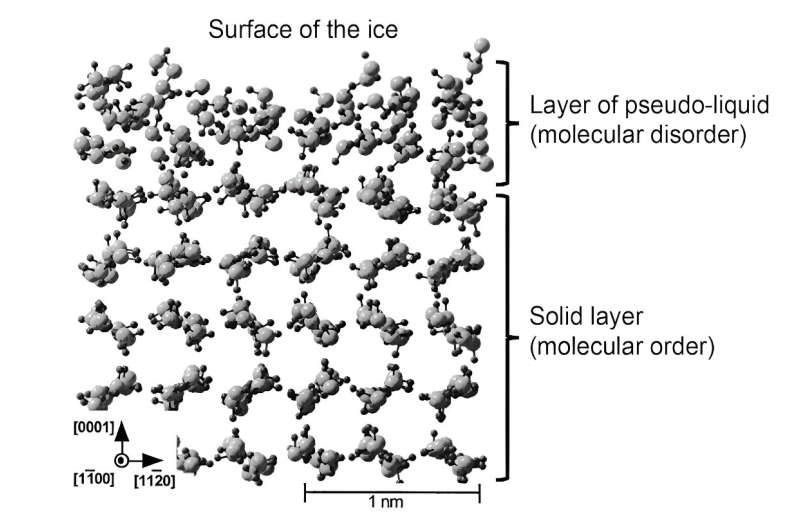
Più recentemente, le simulazioni hanno permesso di rappresentare meglio la struttura di questo strato liquido. Successivamente questo strato venne denominato "pseudo-liquido" o "quasi-liquido" per differenziarlo dalla vera fase liquida. Tale lavoro teorico ha dimostrato che in questo strato superficiale le molecole sono in grado di muoversi più liberamente, confermando il suo ruolo di lubrificante. Tuttavia, la struttura molecolare non è esattamente la stessa dell'acqua liquida, il che ha conseguenze sulle proprietà meccaniche di questo strato pseudoliquido.
Un recente studio ha mostrato una forte correlazione tra la mobilità individuale delle molecole e il coefficiente di attrito macroscopico (più basso è il coefficiente, più facile è scivolare), suggerendo che non è tanto lo spessore dello strato che conta per lo scivolamento ma piuttosto il movimento individuale delle molecole. Il valore minimo del coefficiente di attrito è misurato a -7°C, conosciuta come la temperatura ottimale per sciatori e pattinatori.
Altre ricerche sono andate al cuore dello strato pseudo-liquido utilizzando una nanosonda, la punta di un microscopio a forza atomica. Facendo vibrare questa punta collegata ad un sensore di forza estremamente preciso, misurando l'attrito tra la punta e il liquido nello strato, gli autori hanno misurato che questo liquido può essere 50 volte più viscoso dell'acqua liquida, e che possiede anche elasticità (una proprietà maggiormente associato allo stato solido). Questa viscosità è simile a quella dei tuoi oli commestibili, rendendo lo strato pseudo-liquido un eccellente lubrificante.
Riassumendo:il ghiaccio scivola perché sulla sua superficie si forma uno strato liquido di circa 1-100 nanometri di spessore. Le sue proprietà meccaniche (viscosità, elasticità), diverse da quelle dell'acqua liquida, e la mobilità delle molecole che la compongono, molto maggiore di quella del ghiaccio solido, le conferiscono eccezionali proprietà lubrificanti.
La viscosità del ghiaccio, tuttavia, continua a confondere gli scienziati, nonostante 70 anni di esperimenti. In quest'ultimo caso, gli scienziati hanno fatto ricorso a un kit piuttosto semplice:un pistone collegato a un sensore di forza spinge un blocco di ghiaccio, a sua volta attaccato a un oggetto solido. Quando il cubetto di ghiaccio si stacca, la forza registrata dal sensore diventa improvvisamente zero e viene misurato il valore massimo prima di questo distacco. Ma questi risultati hanno mostrato tendenze talvolta contraddittorie e una dispersione abbastanza ampia.
Una recente revisione sull'argomento ha concluso che la forza di adesione del ghiaccio "dipende non solo dalla composizione chimica, dalla ruvidità superficiale, dalle proprietà meccaniche e termiche del substrato [ma] dipende anche in modo critico dalla temperatura e persino dal dispositivo sperimentale per misurare l'adesione". ."
Per essere un po’ più precisi, quando esploriamo la letteratura sull’argomento negli ultimi 60 anni, notiamo che la forza con cui il ghiaccio aderisce ad un solido dipende fortemente dalla temperatura in un intervallo compreso tra -20°C e 0°C ( il ghiaccio aderisce più duramente a un solido più freddo). Per quanto riguarda il ruolo della ruvidità superficiale, è ambivalente:per alcuni solidi (in particolare i metalli), il ghiaccio aderisce più fortemente a un substrato più ruvido, mentre per alcune plastiche avviene il contrario...
Infine, a livello chimico, l’acqua liquida potrebbe distribuirsi meglio su alcune superfici rispetto ad altre. Ad esempio, l'acqua si diffonde molto bene sul vetro pulito, mentre alcune superfici sono idrofobe, come il Teflon.
Uno studio recente ha dimostrato che quanto più acqua allo stato liquido si sparge sulla superficie di un solido, tanto più ghiaccio aderirà a questo solido. Al contrario, una superficie con poca affinità per l'acqua liquida avrà anche poca adesione per il ghiaccio.
Perché questa relazione tra la diffusione dell'acqua e l'adesione del ghiaccio? Innanzitutto, affinché il ghiaccio aderisca a un solido freddo, l'acqua allo stato liquido deve aver potuto congelare a contatto con il solido. Ecco un semplice esperimento che chiunque può fare:
Cosa possiamo concludere? Intuitivamente, maggiore è l'affinità dell'acqua per la superficie, più facilmente l'acqua liquida penetra nelle asperità e negli interstizi della superficie del solido, aumentando la superficie di contatto tra questa e il ghiaccio dopo la solidificazione, consolidando così l'adesione. Questo esperimento dimostra anche il ruolo dell'acqua liquida come adesivo. Quando si utilizza un adesivo convenzionale, ad esempio una colla liquida, per unire due parti insieme, è quando le parti si solidificano (per evaporazione di un solvente nella colla) che avviene l'adesione forte e definitiva. La stessa cosa accade quando l'acqua liquida si raffredda a contatto con un solido freddo e si solidifica. Lo strato di acqua ghiacciata svolge quindi il ruolo di uno dei solidi.
Non possiamo spiegare in dettaglio l'adesione del ghiaccio, ma possiamo provare a ridurne la forza. L'idea di utilizzare trattamenti idrorepellenti è emersa naturalmente, ma questi trattamenti non sono molto robusti nel tempo e possono avere l'effetto opposto a quello previsto. Soluzioni più promettenti prevedono lo spargimento di un sottile strato di olio o di idrogel sulla superficie, ma ci sono ancora problemi con la stabilità di questi strati su vaste aree.
Un altro approccio consiste nell’utilizzare metodi di sghiacciamento attivi. Una di queste tecniche sono gli ultrasuoni superficiali, che generano “micro-terremoti” sulla superficie solida e possono causare la rottura del ghiaccio. Stiamo attualmente studiando questo metodo nel laboratorio MSC.
Fornito da The Conversation
Questo articolo è ripubblicato da The Conversation sotto una licenza Creative Commons. Leggi l'articolo originale. 