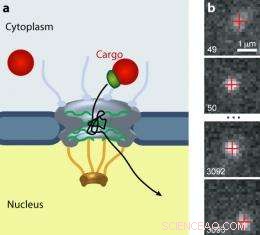
Il complesso dei pori nucleari (NPC) controlla il traffico di tutte le molecole tra il citoplasma e il nucleo delle cellule eucariotiche. (a) I carichi più grandi (rosso) richiedono un ricevitore di trasporto (verde) per passare attraverso il cancello. (b) Un carico di punti quantici si muove attraverso un NPC. Immagine:Alan Lowe
(PhysOrg.com) -- Karsten Weis, ricercatori dell'Università di Berkeley, Jan Liphardt, e colleghi hanno utilizzato sonde fluorescenti chiamate punti quantici per determinare quali molecole entrano nel nucleo attraverso i suoi nanopori e quali vengono espulse. Le loro scoperte potrebbero aiutare a progettare farmaci in grado di attraversare i pori e colpire il DNA di una cellula.
I biofisici QB3 hanno tracciato con una risoluzione senza precedenti i percorsi dei carichi che si muovono attraverso il complesso dei pori nucleari (NPC), un'apertura selettiva su nanoscala che controlla l'accesso al nucleo della cellula, e ha risposto a diverse domande chiave sulla sua funzione.
L'NPC, un grande insieme proteico a forma di rete da basket frangiato di tentacoli, è la porta d'ingresso al nucleo cellulare, dove sono conservate le informazioni genetiche. Ogni nucleo cellulare contiene circa 2, 000 NPC, incorporato nell'involucro nucleare. L'NPC (che è largo circa 50 nanometri) è responsabile di tutti i trasporti dentro e fuori il nucleo. Per evitare che il contenuto del resto dell'interno della cellula si mescoli con quello del nucleo, l'NPC discrimina i carichi con grande precisione.
Diversi virus prendono di mira l'NPC per entrare nel nucleo, e il trasporto disfunzionale tra il citoplasma e il nucleo è stato implicato in molteplici malattie, compreso il cancro.
Gli scienziati hanno costruito modelli per l'NPC, ma come questo canale operi e raggiunga la sua selettività è rimasto un mistero. È risaputo che, per farcela attraverso l'NPC, le grandi molecole devono legare almeno alcuni recettori detti “importine”; non era chiaro se legare più importine velocizzasse o rallentasse il passaggio di una molecola. Così, pure, ha il punto esatto in cui una proteina trasportatrice chiamata "Ran" svolge un ruolo cruciale, sostituendo una molecola di GTP (un combustibile cellulare, un analogo del più noto ATP) per uno di GDP che la grossa molecola porta con sé quando entra nell'NPC.
Karsten Weis, un professore di biologia molecolare e cellulare dell'Università di Berkeley, Jan Liphardt, un professore di fisica dell'Università di Berkeley, e colleghi hanno condotto esperimenti di imaging avanzati che hanno risolto questi problemi. (Weis e Liphardt sono membri di QB3.) La ricerca è stata pubblicata il 1 settembre sulla rivista Natura , in un articolo su cui il post-dottorato di Berkeley Alan Lowe e lo studente laureato Jake Siegel sono stati i primi autori congiunti.
In precedenza, gli scienziati avevano osservato il movimento di piccole molecole (pochi nm di diametro), etichettati con etichette fluorescenti, attraverso l'NPC. Ma il rapido transito e il debole segnale di queste molecole hanno provocato scarsi, dati sfocati. basso, Siegel, et al. impiegati “punti quantici”, che hanno un diametro di circa 20 nm e quindi più lenti delle molecole più piccole e molto più luminose dei fluorofori convenzionali. I ricercatori hanno rivestito i punti quantici con segnali riconosciuti dalle importine. Usando una tecnica microscopica che ha permesso loro di vedere un appartamento, sottile fetta visiva attraverso le cellule viventi, hanno visto entrare centinaia di singoli punti, saltellando dentro, essere espulso da, e in alcuni casi ammessi attraverso, NPC. I ricercatori hanno registrato dati video e tracciato il movimento di 849 punti quantici con precisione nanometrica.
I percorsi simili a spaghetti dei punti quantici, sovrapposti gli uni agli altri, ha rivelato che le particelle rientravano in tre classi:“aborti precoci, ” che sono stati brevemente confinati e poi rimbalzati fuori; “aborti tardivi, ” che vagava dentro e si snodava fino all'estremità interna del poro prima di uscire dal modo in cui erano venuti; e “successi, ” che ha seguito più o meno gli stessi percorsi degli ultimi aborti, ma gli è stato concesso l'ingresso.
Dai meandri erratici dei sentieri, i ricercatori hanno dedotto che i punti quantici si stavano effettivamente diffondendo in modo casuale, piuttosto che essere attivamente trasportato. E l'aggiunta di più importazioni al rivestimento dei punti ha ridotto il tempo di transito, suggerendo che le importazioni rendono il carico in arrivo più solubile all'interno dell'NPC piuttosto che legarsi alle pareti interne.
I ricercatori hanno trovato un risultato particolarmente interessante quando hanno escluso la proteina vettore Ran dall'esperimento. Senza Ran nel mix, i punti quantici seguivano esattamente la stessa gamma di percorsi di quando Ran era presente, tranne che praticamente nessuno è passato attraverso l'NPC.
Considerando i loro dati di percorso, gli autori hanno disegnato un modello per come opera l'NPC. Il carico di grandi dimensioni viene inizialmente catturato dalla frangia di filamenti dell'NPC. Quindi incontra una costrizione, attraverso il quale può entrare in una sorta di anticamera. Quindi, in certi casi, Ran scambia il PIL del carico con un GTP ed è ammesso nel nucleo. Solo il passaggio finale è irreversibile.
"È uno studio elegante, "dice Michael Rout, un professore di biologia cellulare e strutturale presso la Rockefeller University la cui specialità è il trasporto di NPC. "Se alla fine comprendiamo come opera l'NPC al livello più sottile, potremmo forse costruire filtri per selezionare le molecole di interesse."
Infatti, una delle principali nuove intuizioni è che la selettività dell'NPC sembra derivare da una cascata di filtri, ciascuno preferendo carichi corretti, piuttosto che un solo passaggio molto selettivo. Questo aiuta a spiegare perché alcune cose possono facilmente entrare nel nucleo e altre sono escluse. Questa scoperta può avere alcune implicazioni cliniche molto pratiche, Liphardt e Weis dicono. Potrebbe consentire agli scienziati di sviluppare tecniche per consegnare in modo efficiente grandi carichi artificiali, come coniugati farmaco-polimero e agenti di contrasto, al nucleo, che contiene il genoma.