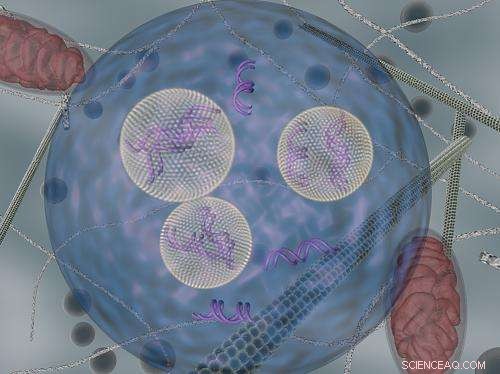
Le nanoparticelle lipidiche (che trasportano siRNA) sono mostrate mentre vengono trasportate all'interno delle cellule mediante vescicole endocitiche. Credito:DARIA ALAKHOVA E GAURAV SAHAY
Le nanoparticelle che rilasciano brevi filamenti di RNA offrono un modo per curare il cancro e altre malattie bloccando i geni malfunzionanti. Sebbene questo approccio abbia mostrato qualche promessa, gli scienziati non sono ancora sicuri di cosa accada esattamente alle nanoparticelle una volta che entrano nelle loro cellule bersaglio.
Un nuovo studio del MIT fa luce sul destino delle nanoparticelle e suggerisce nuovi modi per massimizzare la consegna dei filamenti di RNA che stanno trasportando, noto come RNA interferente corto (siRNA).
"Siamo stati in grado di sviluppare nanoparticelle in grado di fornire carichi utili nelle cellule, ma non abbiamo davvero capito come fanno, "dice Daniel Anderson, il Samuel Goldblith Professore Associato di Ingegneria Chimica al MIT. "Una volta che sai come funziona, c'è il potenziale che puoi armeggiare con il sistema e farlo funzionare meglio."
Anderson, un membro del Koch Institute for Integrative Cancer Research del MIT e dell'Institute for Medical Engineering and Science del MIT, è il capo di un gruppo di ricerca che si è proposto di esaminare come le nanoparticelle e i loro carichi di farmaci vengono elaborati a livello cellulare e subcellulare. I loro risultati appaiono nel numero del 23 giugno di Biotecnologie naturali . Robert Langer, il David H. Koch Institute Professor al MIT, è anche autore del paper.
Un approccio di consegna dell'RNA che ha mostrato una particolare promessa è il confezionamento dei filamenti con un materiale simile ai lipidi; particelle simili sono ora in fase di sviluppo clinico per il cancro del fegato e altre malattie.
Attraverso un processo chiamato interferenza dell'RNA, siRNA mira a RNA messaggero (mRNA), che trasporta istruzioni genetiche dal DNA di una cellula al resto della cellula. Quando siRNA si lega all'mRNA, il messaggio trasportato da quell'mRNA viene distrutto. Lo sfruttamento di questo processo potrebbe consentire agli scienziati di disattivare i geni che consentono alle cellule tumorali di crescere senza controllo.
Gli scienziati sapevano già che le nanoparticelle che trasportano siRNA entrano nelle cellule attraverso un processo, chiamata endocitosi, con cui le cellule inghiottono grandi molecole. Il team del MIT ha scoperto che una volta che le nanoparticelle entrano nelle cellule, rimangono intrappolate in bolle note come vescicole endocitiche. Ciò impedisce alla maggior parte del siRNA di raggiungere il suo mRNA bersaglio, che si trova nel citosol della cellula (il corpo principale della cellula).
Questo accade anche con i materiali di consegna di siRNA più efficaci, suggerendo che c'è molto spazio per migliorare il tasso di consegna, dice Anderson.
"Crediamo che queste particelle possano essere rese più efficienti. Sono già molto efficienti, al punto in cui i microgrammi di droga per chilogrammo di animale possono funzionare, ma questi tipi di studi ci danno indizi su come migliorare le prestazioni, "dice Anderson.
Ingorgo molecolare
I ricercatori hanno scoperto che una volta che le cellule assorbono le nanoparticelle di lipidi-RNA, vengono scomposti entro circa un'ora ed espulsi dalle cellule.
Hanno anche identificato una proteina chiamata Niemann Pick tipo C1 (NPC1) come uno dei principali fattori nel processo di riciclaggio delle nanoparticelle. Senza questa proteina, le particelle non possono essere espulse dalle cellule, dando al siRNA più tempo per raggiungere i suoi obiettivi. "In assenza dell'NPC1, c'è un ingorgo, e siRNA ottiene più tempo per sfuggire a quell'ingorgo perché c'è un arretrato, "dice Gaurav Sahay, un postdoc del MIT e autore principale del documento Nature Biotechnology.
In studi su cellule cresciute in laboratorio senza NPC1, i ricercatori hanno scoperto che il livello di silenziamento genico ottenuto con l'interferenza dell'RNA era da 10 a 15 volte superiore a quello delle cellule normali.
La mancanza di NPC1 provoca anche un raro disturbo da accumulo lisosomiale che di solito è fatale durante l'infanzia. I risultati suggeriscono che i pazienti con questo disturbo potrebbero trarre grandi benefici dalla potenziale terapia con interferenza dell'RNA fornita da questo tipo di nanoparticelle, dicono i ricercatori. Ora stanno progettando di studiare gli effetti dell'eliminazione del gene NPC1 sulla consegna di siRNA negli animali, con l'obiettivo di testare possibili trattamenti con siRNA per il disturbo.
I ricercatori stanno anche cercando altri fattori coinvolti nel riciclaggio delle nanoparticelle che potrebbero costituire buoni obiettivi per rallentare o bloccare il processo di riciclaggio, che credono potrebbe aiutare a rendere i farmaci di interferenza dell'RNA molto più potenti. I possibili modi per farlo potrebbero includere la somministrazione di un farmaco che interferisce con il riciclaggio delle nanoparticelle, o creando materiali di nanoparticelle che possono eludere più efficacemente il processo di riciclaggio.
"Questo documento descrive un modo nuovo e molto importante per migliorare la potenza dei sistemi di consegna di siRNA inibendo le proteine che riciclano il materiale importato fuori dalla cellula, "dice Pieter Cullis, un professore di biochimica e biologia molecolare presso l'Università della British Columbia che non faceva parte del gruppo di ricerca. "È possibile che questo approccio dia luogo a miglioramenti nell'ordine di grandezza della potenza necessari affinché le terapie a base di siRNA siano agenti più generalmente efficaci per il trattamento delle malattie".
Questa storia è stata ripubblicata per gentile concessione di MIT News (web.mit.edu/newsoffice/), un popolare sito che copre notizie sulla ricerca del MIT, innovazione e didattica.