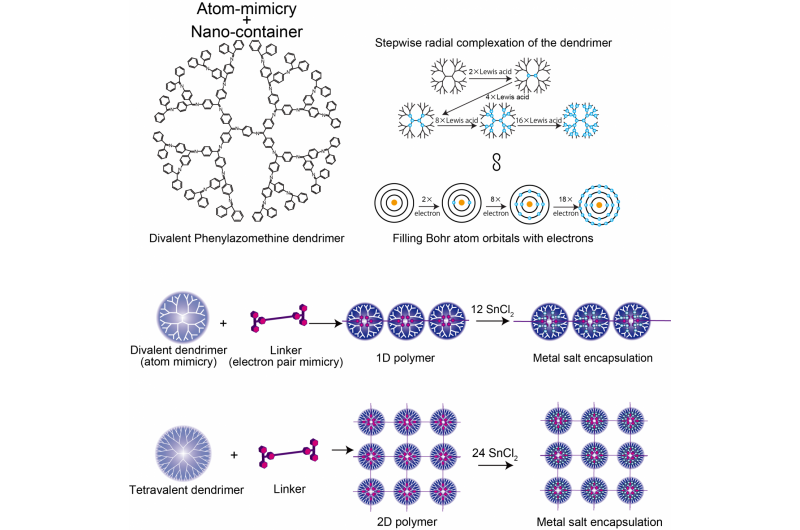
La struttura del dendrimero di fenilazomentina bivalente, Confronto tra il modello dell'atomo DPA e Bohr, e polimero supramolecolare 1D/2D. Credito:Istituto di tecnologia di Tokyo
Nella nanotecnologia il controllo è fondamentale. Il controllo sulle disposizioni e le distanze tra le nanoparticelle può consentire punti di forza di interazione su misura in modo che le proprietà possano essere sfruttate in dispositivi come i sensori plasmonici. Ora i ricercatori del Tokyo Institute of Technology usano dendrimeri che imitano la valenza elettronica degli atomi e li collegano in array usando molecole che si coordinano con il dendrimero in quanto formerebbero una coppia di elettroni covalente nel loro guscio di valenza - "mimetismo di coppia di elettroni".
Kimihisa Yamamoto, Ken Albrecht, e i colleghi della Tokyo Tech hanno considerato la polifenilazometina dendritica (DPA), che ha una struttura che si dirama da un nucleo centrale. Le molecole di "acido di Lewis" si coordinano ai siti "base di Lewis" di DPA. L'analisi del rapporto tra le molecole di acido di Lewis SnCl2 che si coordinano con ciascun dendrimero ha rivelato incrementi di fase da 2 a 4 a 8 a 16, che imita la valenza dell'atomo di Bohr che ha 2, 8, 18, e 32 elettroni nel 1°, 2°, 3°, e 4° orbitale. Ciò riflette l'aumento del numero di molecole che possono coordinarsi con il dendrimero con l'aumentare della distanza dal nucleo, all'aumentare del numero di rami dendrimeri e della densità elettronica.
Il team di Yamamoto ha analizzato il coordinamento del DPA con un acido di Lewis che si lega più forte - il trifenilmetilio (TPM) - legato alla molecola a forma di bastoncino fenilene etinilene. Lo scheletro di phylene ethynlene è sufficientemente rigido che i cationi acidi a entrambe le estremità non possono quindi legarsi allo stesso dendrimero. Si forma invece una catena polimerica di dendrimeri. Utilizzando un diverso dendrimero di partenza (ZnPG4 invece di DPAG4) - che ha una valenza del nucleo di quattro invece di due - ha portato alla formazione di polimerizzazione bidimensionale dei dendrimeri, producendo una serie 2D di nanocontenitori che possono accumulare altri acidi di Lewis negli orbitali esterni.
Il lavoro descrive "un nuovo aspetto del mimetismo atomico" concludono i ricercatori. "La geometria e il passo possono essere controllati dal design del dendrimero e del linker e sono potenzialmente applicabili alla plasmonica (dopo la crescita mediata dai semi) e alle griglie di nanoelettrodi (che sono utili anche come elettrocatalizzatori)."
Lo studio è pubblicato su Progressi scientifici .
Atomo di Bohr
Il modello di Bohr dell'atomo elaborato da Niels Bohr ed Ernest Rutherford nel 1913 descrive l'atomo come un nucleo positivo circondato da elettroni in diversi livelli o livelli di energia. Ogni guscio ha un numero prestabilito di elettroni che possono occuparlo - cioè, due elettroni possono occupare il primo guscio, otto il prossimo, e diciotto il prossimo, e così via.
Mentre ci sono aspetti del comportamento dell'atomo che il modello non copre, è particolarmente efficace nello spiegare le righe di emissione spettrale. Quando eccitato, un elettrone può saltare al livello di energia successivo. Quando ritorna al livello di energia iniziale, la differenza di energie viene emessa come luce alla lunghezza d'onda specifica equivalente alla differenza di energia.
Dove un guscio non è pieno, l'atomo può legarsi con un'altra specie chimica. In questo modo la valenza di un atomo descrive quanto è pieno il guscio dell'elettrone e quanto facilmente si possono formare i legami. Il gradiente di densità elettronica dei dendrimeri che si spostano radialmente dal nucleo verso le regioni esterne più ramificate determina quante molecole coordinanti l'acido di Lewis può ospitare e in questo modo imita i livelli di energia dell'atomo di Bohr.
Cos'è un acido di Lewis?
Un acido di Lewis è una specie chimica che può accettare una coppia solitaria di elettroni da una sostanza chimica che può donare una coppia solitaria, questo è, da una base di Lewis. Questo comportamento è definito dalla struttura elettronica della sostanza chimica. Gli acidi di Lewis includono composti acidi ma anche cationi metallici.
Quando il dendrimero si coordina con gli acidi di Lewis prende il posto della base di Lewis che donerebbe una coppia di elettroni. I ricercatori descrivono il composto acido di-Lewis (molecola linker) come mimetismo di coppia di elettroni.
punti isosbestici
Quando due sostanze chimiche reagiscono, la quantità di luce assorbita può cambiare a seconda di quanta luce assorbono i prodotti rispetto ai reagenti. Se i prodotti e i reagenti assorbono la stessa quantità di luce a una particolare lunghezza d'onda, è descritto come il punto isosbestico.
I ricercatori hanno utilizzato punti isosbestici per identificare gli incrementi di fase nell'acido di Lewis che reagisce con i dendrimeri. Uno spostamento della lunghezza d'onda nel punto isosbestico indica la coordinazione dell'acido di Lewis con lo strato successivo del dendrimero.