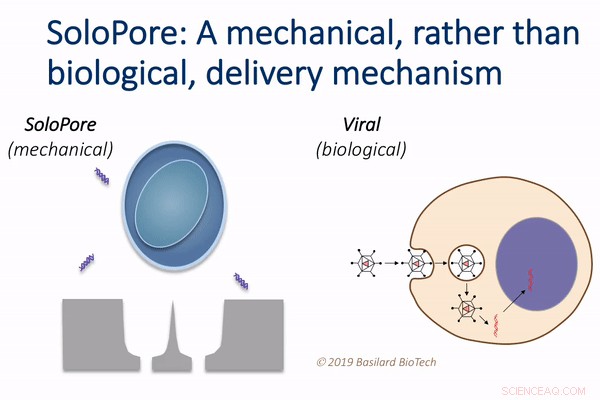
La tecnologia SoloPore di Basilard BioTech, rispetto alla consegna virale. Credito:Basilard Biotech
E se potessi curare il cancro riprogettando le cellule dei pazienti per mirare meglio e distruggere i loro stessi tumori? Con l'avvento di nuove e potenti tecnologie di ingegneria cellulare, questa non è più roba da fantascienza.
Negli ultimi anni, queste tecnologie hanno consentito lo sviluppo di terapie cellulari ingegnerizzate rivoluzionarie per il trattamento del cancro, come le immunoterapie del cancro delle cellule CAR-T per la leucemia e il linfoma. Hanno anche permesso lo sviluppo di trattamenti per malattie genetiche rare, come le terapie geniche HSC per la "malattia di Bubble Boy" e la beta talassemia. I ricercatori di tutto il mondo stanno lavorando al culmine per sviluppare terapie simili per un gran numero di altre malattie mortali e debilitanti.
Ma c'è un problema:con il costo di queste cosiddette "droghe vive" che vanno da poche centinaia di migliaia di dollari a quasi 2 milioni di dollari, non è chiaro se saranno sufficientemente accessibili a tutti i bisognosi.
Ora, in uno spartiacque anticipo, ingegneri dell'Università della California, lungo il fiume, in collaborazione con i ricercatori del City of Hope National Medical Center, hanno inventato un dispositivo che ha il potenziale per la produzione di massa di celle ingegnerizzate a costi inferiori, un punto di svolta per queste terapie salvavita.
In un nuovo articolo sulla rivista Nano lettere , un team di ricercatori guidati da Masaru Rao, professore associato di ingegneria meccanica al Marlan and Rosemary Bourns College of Engineering, descrive una nuova tecnologia di dispositivi microfluidici in grado di affrontare una delle fasi più costose nel processo di produzione della terapia cellulare ingegnerizzata, vale a dire la consegna del gene.
Questa tecnologia, che gli autori chiamano meccanoporazione deterministica, o DMP, utilizza il flusso di fluido per tirare ogni cellula in una grande popolazione sul proprio minuscolo ago. Il flusso viene quindi invertito per rilasciare le cellule dagli aghi, lasciando un poro singolare e precisamente definito all'interno di ogni cellula che consente la consegna del gene.
"Questo semplice, ma l'elegante approccio alla porazione nanomeccanica offre vantaggi significativi rispetto alle tecniche di consegna genica esistenti, " disse Rao. "Per esempio, poiché i vettori virali costituiscono una grande frazione del costo di produzione complessivo delle attuali terapie cellulari, la loro eliminazione attraverso l'uso di DMP ha il potenziale per una notevole riduzione dei costi."
L'esclusivo meccanismo di porazione a sito singolo di DMP è fondamentale, poiché riduce al minimo i danni alla cellula, producendo un percorso ben definito per l'introduzione dei geni. Ciò offre l'opportunità di ottenere sia un'elevata efficienza di consegna che la vitalità cellulare, che è difficile da ottenere utilizzando altre tecniche di consegna non virali, come l'elettroporazione.
"Infatti, nel nostro articolo mostriamo che DMP può progettare cellule T umane primarie, lo stesso tipo di cellule utilizzate nelle terapie CAR-T, con efficienze che superano di oltre quattro volte uno strumento di elettroporazione all'avanguardia, " ha detto Rao.
La tecnologia DMP è stata brevettata da UC Riverside e recentemente concessa in licenza a una nuova società di avvio che Rao ha creato dal suo laboratorio, Basilard BioTech. L'azienda sta cercando di sviluppare la tecnologia, che ha marchiato SoloPore, come una nuova soluzione dirompente per l'ingegneria cellulare ex vivo e terapie geniche per il cancro in particolare, così come le malattie genetiche e le malattie degenerative più in generale.
La carta, "Massicciamente parallelizzato, Meccanoporazione deterministica per la consegna intracellulare, " è pubblicato sulla rivista, Nano lettere .