
Proprietà nanomeccaniche delle fibrille di ILQINS. a) altezza AFM, b) altezza AFM 3D, c) ampiezza AFM, e d) modulo AFM DMT delle fibrille ILQINS. e) Modulo DMT delle fibrille ILQINS dalla parte (d). f) L'istogramma dei moduli DMT delle fibrille di ILQINS. Credito: Scienze avanzate , doi:10.1002/advs.202002182
Gli amiloidi si riferiscono a depositi fibrosi anormali extracellulari e proteici trovati in organi e tessuti che formano costrutti insolubili resistenti alla degradazione. La loro formazione può accompagnare la malattia, dove ogni malattia è caratterizzata da uno specifico aggregato proteico o peptidico. Le proprietà nanomeccaniche delle fibrille amiloidi e dei nanocristalli dipendono dalla loro struttura secondaria e quaternaria e dalla geometria intermolecolare. Gli scienziati hanno utilizzato metodi di imaging avanzati tra cui la microscopia a forza atomica (AFM) per svelare l'eterogeneità morfologica e meccanica delle amiloidi, sebbene sia difficile ottenere una comprensione completa basata sui metodi spettroscopici convenzionali.
In un recente rapporto ora pubblicato su Scienze avanzate , Jozef Adamcik e un team internazionale di ricercatori dell'ETH di Zurigo, l'Università di Cambridge, l'Università del Lussemburgo e l'Università di Shanghai, dimostrato metodi combinati di nanospettroscopia a singola molecola. Hanno combinato le tecniche con la modellazione atomica per comprendere la transizione strutturale delle fibrille amiloidi ai microcristalli amiloidi basati su esapeptidi su scala nanometrica. Hanno attribuito l'origine dell'irrigidimento a un maggiore contenuto di strutture intermolecolari a fogli . L'aumento della rigidità nei moduli di Young è correlato all'aumento della densità dei legami idrogeno intermolecolari e alle strutture parallele di fogli per stabilizzare energeticamente i cristalli.
Amiloidi nella scienza dei materiali
Gli amiloidi sono strutture altamente ordinate derivanti da proteine o peptidi e associate a una serie di malattie tra cui numerose malattie neurodegenerative come l'Alzheimer, Parkinson, malattie di Creutzfeldt-Jakob, ed encefalopatie spongiformi bovine. Comprendere le loro proprietà biofisiche può fornire molte nuove informazioni per inibire la loro formazione. Nella scienza dei materiali, però, la capacità di un gran numero di peptidi e proteine di autoassemblarsi in strutture amiloidi apre un metodo per usarli per sviluppare nuovi nanomateriali per applicazioni biomediche e nanotecnologiche. Di conseguenza, gli scienziati dei materiali sono desiderosi di ottenere una conoscenza dettagliata della struttura e della morfologia degli amiloidi in un contesto più ampio per applicazioni dalla medicina alla nanotecnologia. In questo lavoro, Adamcik et al. ha esaminato il polimorfismo dei sistemi modello esapeptidi e ha utilizzato le capacità di singola molecola della microscopia a forza atomica di mappatura nanomeccanica quantitativa peakforce (PF-QNM-AFM) per l'analisi. Il metodo ha combinato l'AFM (microscopia a forza atomica) e le tecniche infrarosse con la modellazione atomica per studiare e correlare la nanomeccanica, proprietà chimiche e strutturali della fibrilla e delle sue forme cristalline alla scala di un singolo aggregato.

Proprietà nanomeccaniche delle fibrille IFQINS (F), cristalli intermedi (IC), e cristalli (C). a) altezza AFM, b) altezza AFM 3D, c) ampiezza AFM, e d) modulo AFM DMT delle fibrille IFQINS. e) Modulo DMT delle fibrille IFQINS dalla parte (d). f) L'istogramma dei moduli DMT delle fibrille IFQINS. Il colore rosso corrisponde ai moduli DMT delle fibrille, il verde mostra i cristalli intermedi e il blu corrisponde ai moduli DMT dei cristalli. Credito: Scienze avanzate , doi:10.1002/advs.202002182
Microscopia a forza atomica a mappatura nanomeccanica quantitativa della forza di picco (PF-QNM-AFM)
Il team ha prima analizzato individualmente gli esapeptidi ILQINS (un segmento che forma l'amiloide) per comprendere la differenza nelle proprietà nanomeccaniche e strutturali. Hanno estratto i moduli di Young di circa 30 diverse fibrille con valori (2-3 GPa) tipici delle fibrille amiloidi. Hanno quindi osservato un altro IFQINS esapeptide, un altro segmento che forma l'amiloide, per mostrare la coesistenza di fibrille con una struttura di nastri elicoidali destrorsi, nastri ritorti destrorsi e mancini, cristalli intermedi e cristalli. In questo caso, i moduli di Young erano diversi, e ha permesso ai ricercatori di distinguere ciascuna morfologia strutturale. Per esempio, le fibrille mostrate in rosso avevano moduli di Young nell'intervallo 2-3 GPa molto simili alle fibrille autoassemblate da ILQINS. Per i cristalli raffigurati in blu, i moduli erano nell'intervallo 5-6 GPa, mentre i cristalli intermedi visti in verde erano sparsi su 2-5 GPa. Inoltre, le strutture amiloidi TFQINS autoassemblate in microcristalli con un piccolo numero di nastri ritorti, con tendenze simili agli esapeptidi IFQINS. Il team ha anche ottenuto un'analisi dettagliata dei moduli di Young di una transizione da fibrilla a cristallo di TFQINS.
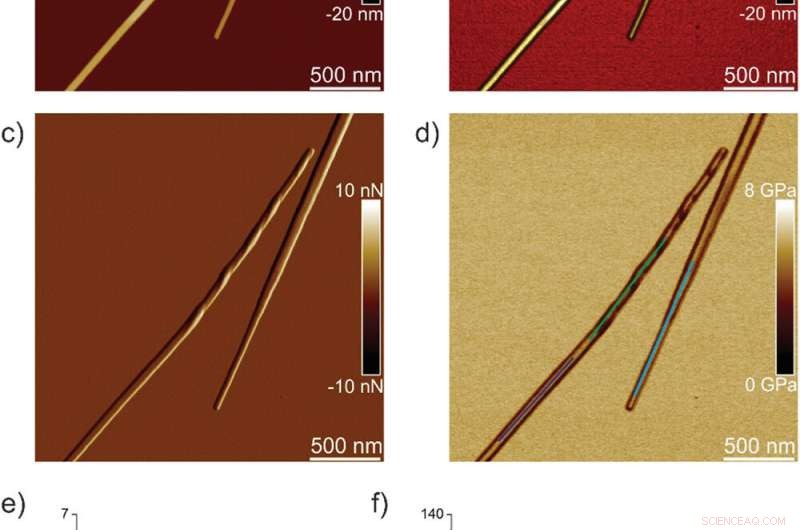
Proprietà nanomeccaniche dei cristalli TFQINS. a) altezza AFM, b) altezza AFM 3D, c) ampiezza AFM, e d) modulo AFM DMT dei cristalli TFQINS. e) Modulo DMT dei cristalli TFQINS dalla parte (d). f) L'istogramma dei moduli DMT dei cristalli TFQINS dalla parte (e). Credito: Scienze avanzate , doi:10.1002/advs.202002182
Nanospettroscopia a infrarossi (AFM-IR)
Adamcik et al. ha quindi applicato la spettroscopia a infrarossi (IR) per comprendere ulteriormente la correlazione tra le proprietà nanomeccaniche e l'eterogeneità della struttura chimica secondaria di singole fibrille e cristalli. Hanno selezionato i peptidi IFQINS per gli esperimenti con lo strumento AFM-IR a causa della sua eterogeneità. Gli scienziati hanno osservato mappe morfologiche utilizzando la tecnica per mostrare la coesistenza di fibrille e cristalli attorcigliati su scala nanometrica. Il sistema AFM-IR ha permesso la risoluzione spettroscopica delle bande ammidiche che sono tipicamente note come impronte di proteine o peptidi. Gli scienziati hanno studiato i sottili cambiamenti strutturali durante la transizione dal cristallo fibrillare a quello intermedio allo stato cristallino, per indicare un aumento netto del contenuto di fogli paralleli intermolecolari e un leggero aumento della conformazione dei fogli β antiparalleli. Il team ha attribuito il risultato all'aumento del modulo di Young dalla fibrilla agli stati cristallini, dove il metodo della spettroscopia IR e l'indentazione AFM hanno fornito una sinossi dell'organizzazione su scala atomica.
Simulazioni atomiche
I ricercatori hanno poi condotto simulazioni atomistiche del processo di indentazione per indagare ulteriormente sui cambiamenti nelle proprietà del materiale amiloide dopo aver acquisito l'ordine simile al cristallo. Hanno usato i peptidi ILQINS per queste simulazioni per comprendere le versioni dei modelli di amiloide spessa e sottile. La struttura sottile aveva una struttura portante meno compatta rispetto alla struttura spessa. I moduli dei cristalli di Young hanno superato quelli delle amiloidi ritorte di 3,6 GPa per mostrare che l'ordinamento dei cristalli è maggiore delle fibrille, proprio come con il rientro sperimentale. Presi insieme, i risultati hanno mostrato che la transizione fibrillare-cristallo nell'amiloide è associata ad un aumento del -sheet intermolecolare e del legame idrogeno che ha portato allo spostamento della banda dell'ammide I a frequenze vibrazionali più basse. Questo spostamento ha permesso alla struttura cristallina di diventare stabile in base all'entropia vibrazionale e all'ordine a lungo raggio dei legami H. Il lavoro ha fornito un chiaro processo di transizione da fibrilla a cristallo per formare cristalli di tipo amiloide eccezionalmente stabili.
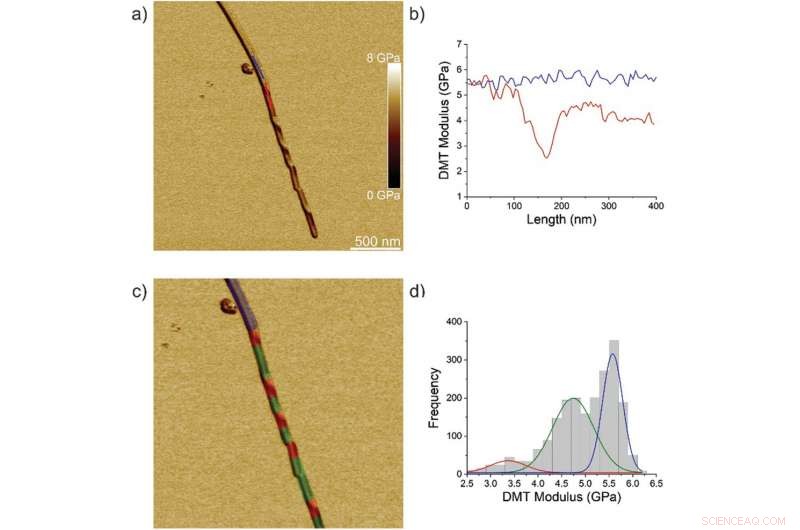
Proprietà nanomeccaniche della transizione fibrillare/cristallo TFQINS. a) Modulo AFM DMT del cristallo TFQINS. b) Modulo DMT del cristallo TFQINS dalla parte (a). c) modulo AFM DMT del cristallo TFQINS colorato di rosso, verde o blu in base alla regione assegnata. d) L'istogramma dei moduli DMT dei cristalli TFQINS. I colori rosso e verde indicano sezioni contorte o piatte della regione di transizione fibrillazione/cristallo, rispettivamente; il blu corrisponde alla regione cristallina. Credito: Scienze avanzate , doi:10.1002/advs.202002182
Veduta
In questo modo, Jozef Adamcik e colleghi hanno combinato l'imaging di microscopia a forza atomica a singola molecola, nanoindentazione e spettroscopia chimica su nanoscala con modellazione atomica per comprendere le proprietà nanomeccaniche e vibrazionali dei polimorfi amiloidi. Hanno osservato la transizione dalle fibrille ai microcristalli e hanno studiato una serie di frammenti esapeptidi (compresi ILQINS, IFQINS, e TFQINS). Le fibrille amiloidi e i microcristalli hanno mostrato diversi moduli di Young, dove i cristalli di amiloide avevano valori maggiori a causa della maggiore densità e ordine dei fogli β intermolecolari nelle architetture microcristalline. Il lavoro ha fornito una mappa senza precedenti dell'atomismo, mesoscopico, e proprietà vibrazionali dell'aggregato amiloide per elaborare le origini molecolari dei cristalli amiloidi termodinamicamente stabili per applicazioni dalla scienza dei materiali alla nanomedicina.
© 2020 Scienza X Rete