Le molecole biologiche chiamate peptidi svolgono un ruolo chiave in molte attività biologiche, compreso il trasporto di ossigeno ed elettroni. I peptidi sono costituiti da corte catene di aminoacidi, gli elementi costitutivi delle proteine. Sono anche fonte di ispirazione per nuovi tipi di biotecnologia.
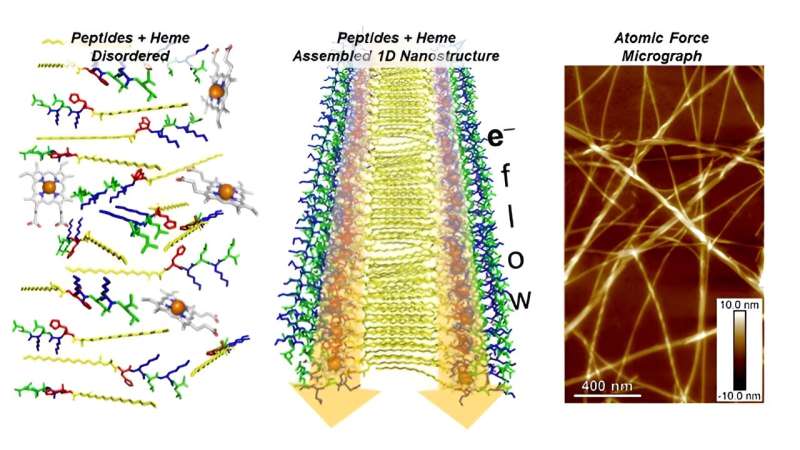
I ricercatori stanno sviluppando una forma sintetica di un peptide che si autoassembla in fibre su scala nanometrica che conducono elettricità quando combinate con l'eme. L'eme è una sostanza che aiuta le proteine in natura a spostare gli elettroni da un luogo all'altro.
I ricercatori hanno determinato in che modo la conduttività elettrica delle loro nanofibre peptidiche veniva influenzata dalla lunghezza della sequenza di amminoacidi nel peptide e dalla loro identità
I parametri strutturali dei peptidi in natura determinano la loro funzione e la loro promessa per la biotecnologia. Questi parametri includono la lunghezza della sequenza, ovvero la lunghezza dei segmenti peptidici che compongono le catene peptidiche complete. Includono anche il modo in cui alcuni amminoacidi sono disposti in un peptide. La ricerca è stata pubblicata sulla rivista Nanoscale nel giugno 2022.
I risultati di questo studio aiutano i ricercatori a progettare gruppi di peptidi che formano fibre su scala nanometrica e trasportano elettroni su lunghe distanze, il che potrebbe rendere queste fibre utili nei dispositivi medici, nei biosensori per un'ampia gamma di applicazioni e nella robotica. Sono anche promettenti nello sviluppo di nuovi enzimi, che le aziende utilizzano per produrre e migliorare prodotti come prodotti per la pulizia della casa e per uso medico.
I campi della ricerca sui materiali e sulla biochimica esplorano le nanostrutture di proteine e peptidi presenti in natura. Queste nanostrutture sono molto promettenti come materiali bioelettronici. Lo sviluppo di un analogo sintetico in grado di formare nanostrutture unidimensionali (1D) migliorerebbe notevolmente la comprensione del sistema naturale da parte degli scienziati e fornirebbe una piattaforma per lo sviluppo di nuovi materiali.
I ricercatori del Center for Nanoscale Materials dell’Argonne National Laboratory hanno studiato una serie di peptidi che si autoassemblano in nanostrutture stratificate 1D. I peptidi PA-(Kx)n sono indicati semplicemente come PA-Kxn, dove PA è c16-AH con c16-A che è alanina modificata (A) e H è istidina, K è lisina, n è la lunghezza della ripetizione della sequenza (1– 4) e x è l'amminoacido leucina (L), isoleucina (I) o fenilalanina (F).
Il team ha determinato in che modo la lunghezza della sequenza peptidica (n) e l'identità dell'amminoacido idrofobico influenzano i fattori chiave:l'affinità di legame dell'eme con i peptidi preassemblati, la densità dell'eme e le proprietà elettroniche.
Con una lunghezza di sequenza pari a 2, l'assemblaggio peptidico ha prodotto la massima affinità di legame. Gli assemblaggi su scala nanometrica risultanti hanno prodotto matrici ordinate della molecola elettroattiva eme. Tutti i peptidi, ad eccezione di PA-KL1, avevano nanofibre con un lungo rapporto d'aspetto indipendentemente dalla lunghezza e dalla sequenza dell'unità ripetuta. Tali strutture hanno una potenziale utilità come materiali bioelettronici supramolecolari utili nel rilevamento biomedico e nello sviluppo di materiali enzimatici.
Ulteriori informazioni: H. Christopher Fry et al, Progettazione di complessi di anfifili peptidici multieme 1D che ricordano i sistemi naturali, Nanoscala (2022). DOI:10.1039/D2NR00473A
Informazioni sul giornale: Nanoscala
Fornito dal Dipartimento dell'Energia degli Stati Uniti